| 病名 | 糖尿病 |
|---|
| 別名 | diabetes mellitus |
|---|
糖尿病(diabetes mellitus)是一組常見的代謝內分泌病,分原發性及繼發性兩類。前者佔絕大多數,有遺傳傾向,其基本病理生理為絕對或相對胰島素分泌不足和胰升糖素活性增高所引起的代謝紊亂,包括糖、蛋白質、脂肪、水及電解質等,嚴重時常導致酸鹼平衡失常;其特徵為高血糖、糖尿、葡萄糖耐量減低及胰島素釋放試驗異常。臨床上早期無症狀,至症狀期才有多食、多飲、多尿、煩渴、善飢、消瘦或肥胖、疲乏無力等症群,久病者常伴發心腦血管、腎、眼及神經等病變。嚴重病例或應激時可發生酮症酸中毒、高滲昏迷、乳酸性酸中毒而威脅生命,常易併發化膿性感染、尿路感染、肺結核等。
我國首次糖尿病調查於1978~1979年在上海10萬人口中發現患病率為10.12%),1980~1981年在全國14省市30萬人口中患病率為6.09%(標化患病率6.74%),當時我國約有700萬糖尿病患者。本病多見於中老年,患病率隨年齡而增長,自45歲後明顯上升,至60歲達高峰。國內各地區患病率相差懸殊,以寧夏最高(10.94%)、北京次之,貴州最低(1.51%)。職業方面,幹部、知識分子、退休工人、家庭婦女較高,農民最低,腦力勞動者高於體力勞動者,城市居民高於農村中人。體重超重者(體重質量指BMI≧24)者患病率3倍於體重正常者。民族方面以回族最高,漢族次之,少數民族與漢族相仿。我國糖尿病絕大多數屬Ⅱ型(NIDDM),上海10萬人中20歲以下者僅1人(0.09%),IDDM的確切患病率據上醫大兒童醫院調查研究80~91年及89~93年期間分別為萬分之0.61和0.83。
1994~1995年在全國約25萬人口中(>25歲),又進行了一次調查,發現糖尿病和IGT各佔2.5%,患病數較15年前增長了三倍多,其主要原因是生活水平提高,生活方式現代化,體力活動減少,營養過剩。根據病因可分原發和繼發性兩大類:原發性者佔絕大多數,病因和發病機理不明。繼發性者佔少數,如肢端肥大症中垂體性糖尿病、柯興綜合徵中類固醇性糖尿病等。
(一)糖尿病 各型特點如下:
1.胰島素依賴型(IDDM,Ⅰ型) 其特徵為:①起病較急;②典型病例見於小兒及青少年,但任何年齡均可發病;③血漿胰島素及C肽水平低,服糖刺激後分泌仍呈低平曲線;④必須依賴胰島素治療為主,一旦驟停即發生酮症酸中毒,威脅生命;⑤遺傳為重要誘因,表現於第6對染色體上HLA某些抗原的陽性率增減;⑥胰島細胞抗體(ICA)常陽性,尤其在初發病2~3年內。有時在發病前數年常已呈陽性反應。近年來研究表明在Ⅰ型患者的鑒定中,谷氨酸脫羧酶抗體(抗GAD)陽性反應較ICA更有意義,尤其在病程較久,發展較慢的患者。
2.非胰島素依賴型(NIDDM,Ⅱ型) 其特徵為:①起病較慢;②典型病例見於成人中老年,偶見於幼兒;③血漿胰島素水平僅相對性降低,且在糖刺激後呈延遲釋放,有時肥胖病人空腹血漿胰島素基值可偏高,糖刺激後胰島素亦高於正常人,但比相同體重的非糖尿病肥胖者為低;④遺傳因素亦為重要誘因,但HLA屬陰性;⑤ICA呈陰性;⑥胰島素效應往往甚差;⑦單用口服抗糖尿病藥物,一般可以控制血糖。根據體重又可分為不胖和肥胖兩型。在不胖的NIDDM中,實際上尚包括一些自身免疫病變進行甚慢的Ⅰ型患者,其初期臨床表現酷似NIDDM而按MIDDM處理,久後終於逐步充分表現出Ⅰ型的特點,必須應用胰島素才能免於發生酮症酸中毒,故在確診時,年齡往往較大,抗GAD陽性結果明顯高於NIDDM,76%:12%。可稱之謂成人遲發自身免疫型糖尿病(LADA),有人也稱1.5型糖尿病。晚近國內外報導的線粒體基因突變糖尿病,由於其臨床特點呈不典型NIDDM:起病早,無肥胖,病程中常需改用胰島素治療和胰島β細胞功能日益減退,同時尚伴有神經性耳聾,故很可能即屬於LADA之一種。目前對線粒體糖尿病的認識正在深入中。
治標更全面、根本、無毒、有效
 | 頂新製油 大絕韻 木崗雞蛋 每日C 味全 貝納頌 大醇豆 LCA506 36法郎 Jagabee加卡比薯條 康師傅 順胜實業 頂伸貿易 正義 統一眼鏡 應宏科技 台灣之星 德克士 崑山帆宏 福滿家(廣州市) 全家(中國) |
3.與營養不良有關的糖尿病 其特徵為:①此型大多見於亞、非、南美等第三世界發展中國家,在熱帶或亞熱帶地區,故又稱熱帶性胰源糖尿病等,命名多種,後經WHO定名為與營養不良有關的糖尿病;②起病年齡大多為青少年(15~30歲);③形體消瘦,營養不良;④不少病例須用胰島素治療,有時劑量偏大;⑤但酮症不多見;⑥此型又可分下列二亞型:
⑴胰纖維結石型:①病理上以慢性胰纖維化,胰體縮小,胰管擴大,內有鈣化結石,以致外分泌與內分泌均受累;②起病於青少年,男女之比為3︰1;③以慢性反覆發作性腹痛、腹瀉、消化不良、營養缺乏等慢性胰病為特徵;④血糖有時可很高,達400~600mg/dl(22~33mmol/L);⑤約80%須胰島素治療;⑥但即使停藥,酮症罕見;⑦病人大多於40~50歲死亡,亦可呈各種慢性糖尿病併發症;⑧目前病因不明,有疑為多食木薯而得慢性CN中毒引起。此病又稱Z型,因1955年首見於Zuidema。相似病例,我院曾見1例,有病理解剖證實。
⑵蛋白質缺乏型:此型又稱J型或M型,因1955年首見於Jamaica。特徵為:①起病於15~25歲的青少年;②有長期蛋白質與能量營養不良史,以致極度消瘦,BMI常<19;③血糖中度升高,須胰島素治療;④酮症罕見;⑤亞洲此病男女之比為2~3︰1,非洲男女相等,西印度則以女性較多;⑥病因不明,可能由於長期營養不良,β細胞數及功能低下所致,但與IDDM不同,糖刺激後仍有C肽釋放。
4.繼發性及其他
⑴胰源性:由於胰腺切除、胰腺炎、胰癌、血色病等引起的胰島素分泌不足。
⑵內分泌性:①垂體性糖尿病,由於生長激素分泌過多,見於肢端肥大症或巨人症;②類固醇性糖尿病,由於皮質醇類激素分泌過多,見於庫欣病或綜合徵;③胰升血糖不經瘤所致的糖尿病,由於胰島A(α)細胞瘤分泌胰升血糖素過多;④胰生長抑素瘤所致的糖尿病,由於胰島D(δ)細胞腺瘤分泌生長抑素過多等。
⑶藥源性及化學物性:多種藥物、化學物可影響糖代謝。如利尿降壓藥噻嗪米、糖皮質激素、女性口服避孕藥、止痛退熱(阿司匹林、消炎痛等)、三環抗抑制劑中阿密替林、去甲丙咪嗪等大都僅能引起糖耐量減退。
⑷胰島素受體異常:又分:①受體本身缺陷有先天性脂肪營養異常症(congenital lipodystrophy)及黑棘皮病伴女性男性化;②受體抗體所致的胰島素耐藥性糖尿病。
⑸遺傳性綜合徵伴糖尿病:有多種:①代謝紊亂如Ⅰ型肝糖原沉著症、急性陣發性血卟啉病、高脂血症等;②遺傳性神經肌肉病如糖尿病性視神經萎縮伴尿崩症與耳聾等;③早老綜合徵;④繼發於肥胖的葡萄糖不耐受性綜合徵如Prader-Willi綜合徵。
(二)葡萄糖耐量減退(impaired glucose tolerance,簡稱IGT) 此組按診斷標準血糖空腹期<140mg/dl(7.8mmol/L)餐後2小時<200mg/dl(11.1mmol/L)但高於正常者,口服糖耐量試驗(OGTT)曲線亦介乎糖尿病與正常高限之間。此組特徵為:血糖偏高,但未達糖尿病標準,係糖尿病的候選者,可分為肥胖型和不胖型。這類對像如不及時干預約2/3可轉變為糖尿病,飲食和運動干預可減少發病,故為預防發生糖尿病的重要對像之一。
(三)妊娠期糖尿病(gestational diabetes mellitus,簡稱GDM) 此組限於婦女妊娠期發生的IGT與DM,故已知糖尿病者妊娠時不屬此組。大多數病人於分娩後隨訪OGTT可恢復正常,僅30%以下病人於5~10年隨訪中轉變為真正糖尿病(按WHO標準)。此組病人約見於所有孕婦的1~2%。
胰島素絕對不足大多見於Ⅰ型(IDDM),相對不足大多見於Ⅱ型(NIDDM)病者。絕對不足的證據有以下幾點:①空腹血漿胰島素濃度很低,一般<4µU/ml(正常值為5~20µU/ml),甚至測不出;血及24小時尿中C肽均很低,常不能測出;②用葡萄糖或胰升糖素刺激後血漿胰島素及C肽仍低,呈扁平曲線;③對磺酰脲類治療無效;④病理切片上示胰島炎,早期有淋巴細胞等浸潤;後期β細胞呈透明變性、纖維化,β細胞數僅及原來10%。相對性胰島素分泌不足表現於空腹血漿胰島素及葡萄糖刺激後胰島素釋放試驗中的濃度均低於相應體重的非糖尿病者。但肥胖的Ⅱ型糖尿病者血漿胰島素濃度基值或刺激後高峰均比正常對照為高,僅比相應體重而非糖尿病者低且高峰延遲出現。葡萄糖刺激後正常人胰島素高峰見於口服糖後30~60分鐘內,Ⅱ型病人的高峰約延遲30~45分鐘出現。見圖1。
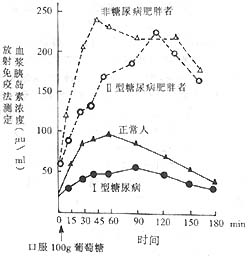
圖1 胰島素釋放試驗中正常人、非糖尿病肥胖者及Ⅱ型糖尿病肥胖者與Ⅰ型糖尿病人血漿胰島素濃度對比
註:①正常人空腹血漿胰島素濃度為5~20µu/ml,口服100g糖後明顯增高,約45分鐘時達最高峰,胰島素濃度為250µu/ml以上,3小時後未恢復正常。
②肥胖者(非糖尿病人)空腹血漿胰島素濃度比正常人為高,口服100g糖後90~120分鐘才出現高峰,但低於正常。
③Ⅰ型糖尿病者空腹血漿胰島素濃度稍低於正常,口服100g糖後90~120分鐘才出現高峰,但低於正常。
④Ⅱ型糖尿病肥胖者空腹血漿胰島素高於正常或正常,口服100g糖後2小時才達高峰,較正常者明顯增高,但較相應體重肥胖而非糖尿病者為低。
⑤上述數據說明糖尿病者分泌胰島素較正常相應體重者為低,且高峰延遲出現,提示胰島素分泌相對不足,Ⅰ型糖尿病(幼年型、消瘦者)分泌更少
Ⅰ型病者每日胰島素分泌量最少,空腹基值及糖刺激後峰值均明顯低於正常,提示絕對分泌不足。體重正常的Ⅱ型病人胰島素分泌量低於正常人,且糖刺激後峰值也低而延遲出現,但肥胖糖尿病人的分泌量大於正常人,且空腹基值和糖刺激後高峰明顯高於正常人,但延遲出現,提示相對性胰島素分泌不足且釋放反應遲鈍。至於胰島素分泌不足的原因則有下列因素:
(一)遺傳因素 不少病人有陽性家族史,我院922例中占8.7%,國外報導約25~50%。遺傳因素不論Ⅰ型或Ⅱ型均較肯定。據近代孿生兒研究,Ⅰ型中共顯性為50%,其餘為環境因素;Ⅱ型中共顯性更高達90%以上。從人類染色體研究中已知Ⅰ型病者第六對染色體短臂上白細胞配伍定型(HLA)等位點上出現頻率增減,提示遺傳屬易感性傾向而非疾病本身。且隨人種與民族而異。大量HLA研究總結認為HLA D及DR抗原與Ⅰ型的關聯最為重要,尤其是DW3-DR3和DW4-DR4易患Ⅰ型糖尿病。最後又發現DQβ鏈變異體,與Ⅰ型糖尿病的關係較DR4更密切。DQβ57非天門冬氨酸和DQα52精氨酸可明顯增加Ⅰ型糖尿病的易感性,但其影響遠不如白種人顯著。Ⅱ型患者則HLA無特殊標誌。
(二)自身免疫 與Ⅰ型患者關係密切。胰小島的自身免疫反應主要可能通過分子模擬(Mimicry)過程所致。如某抗原的化學和構成型與β細胞酷似,則該抗原產生的抗體也將針對β細胞發動免疫攻擊。抗原可以是病毒,也可以是病毒以外的。至於病毒感染後,β細胞嚴重破壞而發生糖尿病的學說,由於在流行方式和病毒血清學研究中尚存在不一致的結果以及從發現胰島細胞損害至出現症狀之間當有一個漫長的潛伏期等事實,均表明尚需重新估價。
具有Ⅰ型糖尿病易感基因個體,如接觸與β細胞組成酷似的外來抗原(孿生抗原),吞噬細胞即聯合Ⅱ類MHC緊密地與之結合,在白介素Ⅰ和Ⅱ的配合下,經輔助T細胞識別後,即對該抗原發動強烈而持久的免疫反應,產生針對該原的特異抗體和免疫活性細胞。由於β細胞酷似外來抗原,因而也受到抗體的攻擊。針對外來抗原的抗體與β細胞結合後,吸引吞噬細胞,補體和自然殺傷細胞,吞噬細胞將自身抗原有關信息傳遞給輔助T細胞,後者進一步擴大針對自身抗原的免疫反應。
Ⅰ型糖尿病患者細胞和體液免疫的證據有:①病者可伴有多種其他免疫性病,如Graves病、橋本氏甲狀腺炎、惡性貧血、原發性慢性腎上腺皮質機能減退症等;②可伴有臟器特異性抗體,包括甲狀腺、胃壁細胞及抗腎上腺抗體等;③起病較急而於6個月內死亡者有胰小島炎;其中有T淋巴細胞、NK細胞和K細胞浸潤;④白細胞移動抑制試驗陽性;⑤胰島細胞抗體(ICA)免疫螢光測定陽性,在Ⅰ型病例發病1~2年內可高達85%(正常人陽性率僅0.5%~1.7%),後漸下降;後又發現胰島細胞表面抗體(ICsA)、補體結合胰島細胞抗體(CF ICA)、細胞毒性胰島細胞抗體(Cytotoxic-ICA)、64K和38K免疫沉澱抗體等。其中ICsA、CF ICA和免疫沉澱抗體選擇性作用於β細胞。⑥近年發現Ⅰ型患者中針對胰小島細胞抗原的抗體,經鑒定系谷氨酸脫羧酸(GAD),在近期發病的Ⅰ型患者中陽性率為69%,在發病3~42年的患者中仍有59%陽性率,遠較病程>3年以上的Ⅰ型患者,ICA的陽性率為高;⑦抑制性T淋巴細胞數及功能降低,K細胞數及活性增高。Ⅰ型患者發病機理見圖2。

圖2 胰島素依賴型糖尿病發病機理
(三)胰島素拮抗激素 據Unger等強調指出,糖尿病中高血糖發病機理不僅由於胰島素相對和絕對不足,而同時必須有胰升血糖素的相對或絕對的過多。正常人血糖過高時胰升血糖素受抑制,但糖尿病者則不受抑制,尤其在酮症酸中毒時,經胰島素治療後方可恢復。未妥善控制的糖尿病中也往往升高。因此,熤中升胰高血糖素血症系一事實,為引起血糖過高的一個組成部分,這是Unger等所提出的二元論學說,即在糖尿病的發病機理中不僅胰島素相對和絕對不足,而尚同時伴有胰升血糖素的相對或絕對的過高,但確切原因未明。
胰島D(δ)細胞分泌的生長抑素(GHRIH,SS)對胰島B(β)細胞分泌胰島素與A(α)細胞分泌胰高血糖素均有抑制作用,且以抑制胰高血糖素佔優勢,故可防治IDDM中撤除胰島素後引起的糖尿病酮症酸中毒。據Unger及Orci推測認為在正常人中此三種細胞分泌三種激素呈旁分泌作用而相互調節,使血糖維持於正常範圍內。當B或D細胞功能低下而分泌不足時均可促使胰升血糖素過多而導致高血糖與糖尿病(三元論學說);但Felig等認為在糖尿病發病機理中仍以胰島素相對或絕對不足為主要病理生理基礎,胰升血糖素的作用僅可加強高血糖或為從屬的次要因素。
(四)Ⅱ型糖尿病機理 Ⅱ型患者的發病機理與Ⅰ型不同,并非因自身免疫β細胞破壞所致,主要在基因缺陷基礎上存在胰島素抵抗和胰島素分泌障礙二個環節。多數學者認為胰島素抵抗系原發異常,但很可能是二者均需存在,只是表現先後,輕重不一而已。可以分為三期:第一期,有胰島素抵抗和高胰島素血症,血漿葡萄糖得以維持正常;第二期,胰島素抵抗加重,雖有高胰島素血症,但胰島素愈高,受體愈不敏感,形成惡性特 ,雖有高胰島素血症,仍出現餐後高血糖症;第三期,胰島素抵抗仍存在,但胰島素分泌降低,導致空腹高血糖症。胰小島分泌功能可因持久的高血糖毒性作用而進一步惡化。在Ⅱ型患者的胰腺中發現有澱粉樣物質沉積,此係37氨基酸多肽稱胰澱素(amylin)。正常時胰澱素與胰島素共同貯存在分泌顆粒中,在胰島素促分泌劑的刺激下與胰島素同時分泌。在動物實驗中,胰澱素可導致胰島素抵抗。在小島中胰澱素的積累可能與Ⅱ型患者在晚期時胰島素分泌衰竭有關。
Ⅱ型或NIDDM患者可以通過以下三水平表現其胰島素抵抗性。
1.胰島素受體前水平 1979年Tager等發現突變胰島素(mutant insulin)引起的糖尿病,於B蓮上第25個氨基酸(苯丙氨酸)為亮氨酸所替代而失效,後又發現B鏈上第24個氨基酸(苯丙氨酸)亦為絲氨酸所替代、A鏈上第3個氨基酸(纈氨酸)為亮氨酸所替代而失效,均引起糖尿病,提示生物合成中胰島素基因突變而形成結構異常和生物活性降低的胰島素導致糖尿病。相似情況由於連接肽上第65個氨基酸(精氨酸)為組氨酸所置換,也有由於連接肽酶可能有缺陷不能使胰島素原(proinsulin)分解去C肽而形成胰島素,以致血循環中胰島素原過多而胰島素不足,導致糖尿病。但此種異常胰島素引起的糖尿病在病因中僅佔極少數。
2.胰島素受體水平 胰島素受體是一跨膜的大分子糖蛋白,由兩個α亞基和兩個β亞基組成。定位於19號染色體短壁上的胰島素受體基因編碼,含有22個外顯子和21個內顯子。
胰島素與細胞α亞基特異性結合後發生構型改變,導致插於細胞內β亞基的酷氨酸激酶活化,這是胰島素發揮其作用的細胞內修飾的第一步。胰島素受體基因突變可通過多種方式影響受體的功能:受體生物合成率降低;受體插入細胞膜過程異常;受體與胰島素的親和力下降;酪氨酸激酶活性降低;受體降解加速。現已有30種以上胰島素受體基因點狀突變或片段缺失與嚴重的胰島素抵抗有關。臨床上也已發現多個綜合徵與胰島素受體基因突變有關,如妖精症,脂肪萎縮性糖尿病等。
3.受體後水平 胰島素與其受體的α亞基結合,β亞基酪氨酸激酶活化後,細胞內發生一系列目前尚未清楚的變化,胞漿內或細胞器內底物發生磷酸化和去磷酸化,取決於靶組織的特性和不同的關鍵酶。胰島素促進各組織的葡萄糖轉運及酵解,肝和肌肉的糖原合成,糖異生和糖原分解的抑制。過程中胰島素需依賴葡萄糖運出體GLUT4及許多關鍵酶如葡萄糖(G)激酶,糖原合成酶,磷酸果糖激酶,丙酮酸激酶和丙酮酸脫氫酶等的活性。在其中,GLUT4和G激酶在胰島素抵抗中的作用,近年來得到深入的研究。GLUT4轉動G依賴於胰島素,後者激活GLUT4并促進其由細胞內微粒體向細胞膜轉位,從而促進G轉入胞內。已發現肥胖症和Ⅱ型糖尿病患者的脂肪細胞內GLUT4基因表達降低,含量減少,導致胰島素作用減弱和胰島素抵抗。G激酶是葡萄糖代謝過程中的第一個關鍵酶,催化G轉變為6-磷酸-葡萄糖,特異地在肝臟和β細胞中表達。許多家系調查調查研究顯示青年人中的成年型熤的家系中,G激酶基因呈連鎖不平衡,併發現某些基因突變,導致胰島素抵抗。Ⅱ型和NIDDM發病機理見圖3,主要是在遺傳基礎上綜合多種因素的後果,其中以胰島素或受體後缺陷和胰島素抵抗以及胰島β細胞分泌功能障礙為主要環節。
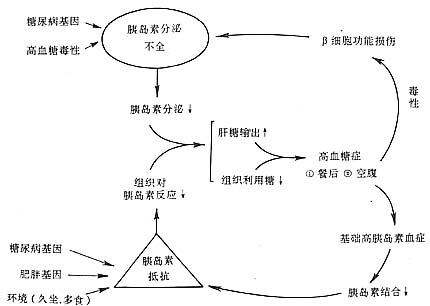
圖3 Ⅱ型糖尿病和NIDDN發病機理
(一)胰島病理 Ⅰ型與Ⅱ型中病理變化不同。Ⅰ型中大多呈胰島炎。胰島數量和β細胞數大減,提示絕對性胰島素缺乏。Ⅱ型中尤其是肥胖者早期胰小島大於正常,β細胞多於正常;呈特殊染色,切片示β細胞顆粒減少。當糖尿病發生5年以上後,則胰小島數、大小及β細胞數均見減少,直至死亡後解剖見幾種典型變化。據Warren等分析811例各種年齡糖尿病人胰島病理結果如下:正常33%,透明變性41%,纖維化23%,水腫變性4%及淋巴細胞浸潤1%。
胰小島透明變民生者其組織化學呈透明物質染伊紅色,分佈於β細胞內,為一種糖蛋白。於電鏡下其亞微結構性質與澱粉樣沉澱物全等,故稱為胰島澱粉樣變,可能即為胰澱素。此種病變較多見於40歲以上的Ⅱ型病者及得病10年以上者。
纖維化者不論Ⅰ型Ⅱ型糖尿病者均可呈胰島纖維化,尤以老年人為多見。在幼年型病者中提示系胰小島炎後果,終於胰島完全纖維化,β細胞常<10%。在Ⅱ型病例中胰島纖維化常伴胰腺泡纖維化與胰內血管硬化。
(二)血管病變 目前威脅糖尿病病人生命最嚴重的病理為心血管病變,約70%以上病人死於心血管性病變的各種併發症;血管病變非常廣泛,不論大中小血管、動脈、毛細血管和靜脈,均可累及,常併發許多臟器病變,特別是心血管、腎、眼底、神經、肌肉、皮膚等的微血管病變。
1.動脈 動脈粥樣硬化見於半數以上病人,發病不受年齡限制,主楞紗及主動脈、冠狀動脈、腦動脈等,常引起心、腦、腎嚴重併發症而致死。周圍動脈尤其是下肢足背動脈等硬化可引起壞疽。
2.微血管 包括毛細血管、微動脈、微靜脈,從光鏡及電鏡下發現糖尿病中微血管病變的特徵為毛細血管基膜增厚:正常基膜厚約80~250nm,糖尿病人基膜增厚可達500~800nm。基膜中有糖類沉積,其中主要為羥賴氨酸相應按比例減少,提示賴氨酸被羥化而成羥賴氨酸,此種微血管病變常伴有微循環異常,為併發許多臟器病變的病理基礎。分佈非常廣泛,尤以腎小球、眼底、神經、心肌、肌肉等的微血管為主,引起腎臟病變、眼底病變、神經病變及心肌等肌肉病變,成為決定患者預後的主要因素。
基膜增厚的發病機理有兩學說:
⑴代謝紊亂學說:從最近研究生化測定,已知此基膜增厚係由於糖蛋白沉積,最明確者為腎小球基膜,也見於腎小球繫膜中。腎小球內皮細胞、上皮細胞及繫膜細胞都能合成此基膜中的物質,在伴有微量白蛋白尿的糖尿病患者中,腎小球繫膜細胞及動脈肌中層(myomedial)細胞增殖,兩者均能合成膠元蛋白Ⅳ連接蛋白和硫酸類肝素蛋白多醣(HS-PG)等細胞外基質(ECM),不僅在數量上較無微量白蛋白患者異常增多,且其質量也有改變:在腎小球硬化症中的腎小球基膜(GBM)內帶負電荷的HS-PG含量明顯降低,在冠狀動脈中也有類似改變。ECM或GBM中HS-PG的降低導致GBM的負電荷降低,白蛋白易於自GBM漏出,動脈也易於發生硬化。因而微量白蛋白尿不僅是糖尿病腎病的而且也是心血管病的危險因素。毛細血管基底膜增厚與高血糖症和生長素旺盛,促使糖化蛋白合成增強,分解減慢有密切關係。
⑵遺傳學說:毛細血管基膜增厚可見於糖尿病前期,但此時代謝紊亂尚不明顯,故認為由於遺傳因素所致。
基膜或ECM主要功能為:保持結構完整和抗增殖作用。基膜增厚時,交鏈度發生改變,加以負電荷降低,通透性增高,小分子蛋白漏出形成微量白蛋白尿,以致蛋白尿和晚期腎臟病變。并可發生眼底視網膜病變和動脈硬化症。
(三)腎臟 有糖尿病性腎小球硬化者占25~44%,可分結節型、瀰漫型及滲出型3種。尤以Ⅰ型糖尿病中為常見,此外,腎盂腎炎及腎小動脈硬化亦常見,壞死性腎乳突炎罕見。死於糖尿病昏迷者可發生急性腎功能衰竭伴腎小管壞死。
(四)肝臟 常腫大,有脂肪浸潤、水腫變性及糖原減少,脂肪肝常見。
(五)心臟 除心壁內外冠狀動脈及其壁內分支呈廣泛動脈粥樣硬化伴心肌梗死等病變外,心肌病變亦已肯定,有屍檢及多種動物模型(包括BB鼠糖尿病)等許多佐證。心肌細胞內肌絲明顯減少,電鏡下可見大量肌原纖維蛋白喪失,嚴重時心肌纖維出現灶性壞死。心肌細胞內有許多脂滴和糖原顆粒沉積。線粒體腫脹、嵴斷裂、基質空化,心肌細胞膜破裂,并可見髓質小體、脂褐素顆粒等形成。閏盤粘合膜細胞間隙增大,BB鼠中糖尿病超過16周者才出現微血管病變,基膜增厚,內皮細胞增生,血管壁增厚,內有PAS染色陽性的糖蛋白及玻璃樣物沉積。血管周呈心肌間質纖維化。
(六)神經系 全身神經均可累及。以周圍神經病變最為常見,呈鞘膜水腫、變性、斷裂而脫落;軸突變性、纖維化、運動終板腫脹等。植物神經呈染色質溶解,胞漿空泡變性及核壞死,膽鹼酯酶活力減少或缺乏,組織切片示植物神經呈念珠狀或梭狀斷裂,空泡變性等。脊髓及其神經根呈萎縮及橡皮樣變,髓鞘膜變薄,軸突變薄,重度膠質纖維化伴空泡變性,前角細胞萎縮而代之以脂肪組織。糖尿病昏迷死亡者腦水腫常見,神經節細胞多水腫變性。
糖尿病系一慢性進行性疾患,除Ⅰ型起病可較急外,Ⅱ型一般起病徐緩,難於估計時日。後者早期輕症常無症狀,但重症及有併發症者則症狀明顯且較典型。病程漫長,無症狀期困難於估計,至症狀出現或臨床上確診後常歷時數年至數十年不等。有時可始終無症狀,直至腦血管或心臟等嚴重併發症而在臨終前不久才被發現有糖尿病基礎。茲將各期臨床表現分述如下。
(一)無症狀期 病者絕大多是中年以上Ⅱ型糖尿病者,食慾良好,體態肥胖,精神體力一如常人,往往因體檢或檢查其他疾病或妊娠檢查時偶然發現食後有少量糖尿。當測定空腹尿糖時常陰性,空腹血糖正常或稍高,但飯後兩小時血糖高峰超過正常,糖耐量試驗往往顯示糖尿病。不少病者可先發現常見的兼有病或併發症如高血壓、動脈硬化、肥胖症及心血管病、高血脂症或高脂蛋白血症,或屢發化膿性皮膚感染及尿路感染等。Ⅰ型患者有時因生長遲緩、體力虛弱、消瘦、或有酮症而被發現。
在Ⅱ型糖尿病無狀期或僅處於IGT狀態時,患者常常已有高胰島素血症,而在Ⅰ型糖尿病出現症狀前往往已有ICA和GAD的增高。
無症狀期之前實際上尚有一般試驗包括糖耐量試驗均陰性的階段,但這些對象可能有糖尿病家屬史,巨嬰史,或伴有代謝綜合徵,如胰島素抵抗,高胰島素血症,高血壓,高LDL血症和肥胖等,因而是屬於糖尿病的高危對象,WHO現稱潛隱性糖耐量異常。
無症狀糖尿病經飲食或(和)運動等治療,可使病情較易得到控制,防止和減少慢性併發症。
(二)症狀期 此期患者常有輕重不等的症狀,且常伴有某些併發症或伴隨症狀或兼有病。有時本病症狀非常輕微,但兼有病或併發症症狀卻非常嚴重,且有時可先於糖尿病症狀出現,或以主要症狀出現而將糖尿病本身症狀掩蔽。如老年病者常先有冠心病症群(心絞痛、心肌梗塞、心律不齊、心力衰竭等),或腦血管意外症群,但糖尿病症群非常輕微,故臨床上常被忽視或漏診。中年病者可先有尿路感染、肺結核、皮肢癤癰或某些外科情況如膽囊炎、胰腺炎等症狀出現。幼年病者有時可以酮症酸中毒為首發症狀。如空腹及餐後血糖均明顯升高者,一般有下列典型症狀。
1.多尿、煩渴、多飲 由於糖尿,尿滲透壓升高而腎小管回吸收水減少,尿量常增多。病者尿意頻頻,多者一日夜可二十餘次,夜間多次起床,影響睡眠。不僅每次尿多與尿頻,一日尿總量常在2~3L以上,偶可達十餘升。由於多尿失水,病者苦煩渴,喝水量及次數乃增多,可與血糖濃度及尿量和失糖量成正比;當胰島素缺乏及酮症酸中毒時,鈉鉀離子回吸收更困難,多尿加重;常使血漿濃縮,影響滲透壓,可釀成高滲性昏迷等嚴重後果。
2.善飢多食 由於失糖,糖分未能充分利用,伴以高血糖刺激胰島素分泌,食慾常亢進,易有飢餓感,主食有時達1~2斤,菜餚比正常人多一倍以上,尚不能滿足。但有時病者食慾忽然降低,則應注意有否感染、發熱、酸中毒、或已誘發酮症等併發症。多尿、多飲及多食臨床上常稱「三多症」。
3.疲勞、體重減輕、虛弱 由於代謝失常,能量利用減少,氮負平衡,失水和電解質,酮症時更嚴重,患者感疲乏、虛弱無力。尤其是幼年(Ⅰ型)及重症(Ⅱ型)患者消瘦明顯,體重下降可達數十斤,勞動力常減弱。久病幼兒生長發育受抑制,身材矮小,臉色萎黃,毛髮少光澤,體力多虛弱。但中年以上Ⅱ型輕症患者常因多食而肥胖。
4.皮膚瘙癢 多見於女陰部,由於尿糖刺激局部所致。有時併發白念珠菌等真菌性陰道炎,瘙癢更嚴重,常伴以白帶等分泌。失水後皮膚乾燥亦可發生全身瘙癢,但較少見。
5.其他症狀 有四肢酸痛、麻木、腰痛、性慾減退、陽萎不育、月經失調、便秘、視力障礙等。有時有頑固性腹瀉,每日大便2~3次至5~6次不等,呈稀糊狀,一般屬非炎症性而為功能性腹瀉,可能與植物神經功能紊亂有關。有時有體位性低血壓、大汗淋漓、大小便失禁等亦屬嚴重神經系表現,許多症狀由於併發症與兼有病所致。
體徵 早期輕症,大多無體徵。久病者常可發現因失水、營養障礙、繼發感染、心血管、神經、腎臟、眼部、肌肉、關節等併發症而出現各種體徵。肝臟可腫大,尤多見於Ⅰ型病者,適當治療後可恢復。國內病例中呈皮膚黃色瘤及胡蘿蔔素血症者罕見。
(一)尿
1.糖尿 重症病例治前經常有糖尿,但早期輕症僅見於餐後或有感染等應激情況下,不少久病者由於腎糖閾升高,雖有高血糖而無糖尿。尿糖可自微量至10g%以上,一般在0.5%~5g%左右,偶可達15g%以上,每日失糖可自微量至數百克。一般而論,在定量飲食條件下失糖量與病情輕重成正比,與血糖高度亦有關係。決定有無糖尿及尿糖量的因素有三:①血糖濃度,②腎小球濾過率,③腎小管回吸收葡萄糖率。正常人腎糖閾為160~180mg/dl;如菊糖清除率為125ml/min,腎小管能回吸收腎小球濾液中葡萄糖250~300mg/min,故血糖正常時尿中無糖。但不少晚期病者由於腎小動脈硬化、腎小球硬化症等病變,腎血流量減少,腎小球濾過率減低而腎小管回吸收糖的功能相對尚好時,則血糖濃度雖高而無糖尿,臨床上稱為腎糖閾增高。反之如腎小管再吸收糖的功能降至120mg/min以下,則血糖濃度雖在100mg/dl左右仍可有糖尿,臨床上稱為腎糖閾降低,見於腎性糖尿,為本病重要鑒別診斷之一。
2.蛋白尿 一般無併發症病者陰性或偶有白蛋白尿,低於29mg/d或20µg/min,白蛋白尿排泄率在30mg~300mg/d,時稱微量白蛋白尿,表明患者已有早期糖尿病腎病,白蛋白尿排泄率>300mg/d時,稱臨床或大量白蛋白尿,常規尿檢可出現蛋白尿,此時病變已非早期,隨病變發展尿蛋白量較多,可達0.5g %(約相當於4+),每日丟失蛋白質在3g以上(正常人<30mg/d),常引起嚴重低蛋白血症和腎病綜合徵。高血壓、腎小動脈硬化症、心力衰竭者亦常有少量蛋白尿,有時於酮症酸中毒、高滲昏迷伴循環衰竭者或休克失水嚴重影響腎循環時亦可出現蛋白尿。
3.酮尿 見於重症或飲食失調伴酮症酸中毒時,也可因感染、高熱等進食很少(飢餓性酮症)。
4.管型尿 往往與大量蛋白尿同時發現,多見於瀰漫型腎小球硬化症,大都屬透明管型及顆粒管型。
5.鏡下血尿及其他 偶見於伴高血壓、腎小球硬化症、腎小動脈硬化症、腎盂腎炎、腎乳頭炎伴壞死或心力衰竭等病例中。有大量白細胞者常提示有尿路感染或腎盂腎炎,往往比非糖尿病者為多見。有腎乳頭壞死者有時可排出腎乳頭壞死組織,為診斷該病的有力佐證。
(二)血 無併發症者血常規大多正常,但有下列生化改變:
1.血糖 本病Ⅱ型中輕度病例空腹血糖可正常,餐後常超過200mg/dl(11.1mmol/L ),重症及Ⅰ型病例則顯著增高,常在200~400mg/dl(11.1~22.0mmol/L)範圍內,有時可高達600mg/dl(33.0mmol/L)以上。我院1例達1200mg/dl(66.0mmol/L);但此類病者常伴高滲昏迷及糖尿病酮症而失水嚴重經治療後可迅速下降。
2.血脂 未經妥善控制者或未治患者常伴以高脂血症和高脂蛋白血症。尤以Ⅱ型肥胖病人為多,但有時消瘦的病人亦可發生。血漿可呈乳白色混濁液,其中脂肪成分均增高,特別是甘油三酯、膽固醇及游離脂肪酸。有時有乳白色奶油蓋,其最上層為乳糜微粒。大都屬高脂蛋白血症第Ⅴ型。甘油三酯可自正常濃度上升4~6倍,游離脂肪酸自正常濃度上升2倍餘,總膽固醇、磷脂、低密度脂蛋白(LDL)均明顯增高。尤其是有動脈硬化性心血管病及腎臟病變的糖尿病者,脂質上升更明顯,而單純性糖尿病者則升高較少。游離脂肪酸上升更提示脂肪分解加速,反映糖尿病控制較差,與血糖升高有密切關係,較甘油三酯升高更敏感。高密度脂蛋白(HDL2Ch)尤其是亞型2降低,Apo.A1、A2亦降低。
3.血酮、電解質、酸鹼度、CO2結合力與非蛋白氮(尿素氮)等變化將在酮症酸中毒、高滲昏迷、乳酸性酸中毒和腎臟病變等有關節段中敘述。
典型病例有三多症群提示本病。輕症無症狀者診斷完全依靠化驗,常在健康檢查或因其他疾病而偶然發現。不少病者首先發現併發症,然後追溯及本病。但不論有無症狀或併發症,關鍵在於首先考慮到本病的可能性而進行尿、血糖檢查,方可確診。
(一)糖尿 判斷尿糖檢查結果時應注意下面幾種情況。尿糖測定結果僅供診斷參考,而確診糖尿病需依靠血糖測定。
1.如有少量或微量糖尿,且偶然於飯後出現者應進行血糖與糖耐量試驗,并注意到斑氏溶液中硫酸銅系被糖類等還原為一氧化銅而起反應,不少藥物,如嗎啡、水楊酸類、水合氯醛、氨基匹林、對氨苯甲酸、大量檸檬酸、尿酸等和不少其他糖類還可原硫酸銅而發生假陽性結果。故目前廣泛採用葡萄糖氧化酶製成的尿糖試條,可以避免假陽性結果。
2.臨床上有糖尿病徵象或嫌疑而尿糖反覆陰性時,應注意測定空腹及飯後2小時血糖,以便除外腎糖閾升高的情況。
(二)血糖 測定血糖的方法常用的有三種:靜脈血漿葡萄糖(VPG),毛細血管全血葡萄糖(CBG)和靜脈全血葡萄糖(VBG)。其中以前二者最常採用。以不同方法測得的結果略有差異。VPG方法測得的結果較CBG高10%,較VBG高15%左右。分析血糖報告時還須注意除外引起葡萄糖濃度增高的其他情況,如注射糖後、各種內分泌疾患、腦部病變及應激性情況等,後文將述及。輕症或早期尤其是Ⅱ型病者空腹血糖可正常,不可輕易除外,必須作餐後2小時血糖或糖耐量試驗。
(三)糖耐量試驗 對於空腹血糖正常或稍偏高而偶有糖尿的患者,或有糖尿病嫌疑的患者(如有陽性家族史,或反覆小產、早產、死胎、巨嬰、難產、流產的經產婦,或屢發瘡癤癰腫者等),須進行葡萄糖耐量試驗。但空腹血糖明顯增高的重型顯性病例則診斷已能確定,大量葡萄糖可加重負擔,應予免試。
1.口服葡萄糖耐量試驗(oral glucose tolerance test,OGTT) 最常用,以往成人採用一次100g,近年WHO建議用75g(或不論成人或兒童每kg標準體重1.75g,總量不超過75g)口服法。於口服糖前及後1/2、1、2、3小時抽取靜脈血測糖,同時搜集尿標本查尿糖。
結果:正常人(年齡15~50歲)空腹血糖為70~100mg/dl(葡萄糖氧化酶等真糖法),糖吸收高峰見於30~60分鐘內(50歲以上者後移),一般不超過170mg/dl,2小時血糖濃度恢復正常範圍,3小時可降至正常以下。尿糖陰性。100g和75g法相較差別不大,僅後者血糖較早恢復正常。年逾50歲者糖耐量往往生理性減低,於1小時峰值每增高10歲血糖增加10mg/dl。
診斷標準:目前多數採用1985年WHO提出的暫行標準如下:
⑴有糖尿病症狀,任何時候靜脈血漿葡萄糖≧200mg/dl(11.1mmol/L)及空腹靜脈血漿葡萄糖≧140mg/dl(7.8mmol/L)可確診為糖尿病。
⑵如結果可疑,應進行OGTT(成人口服葡萄糖75g),兒童每kg體重1.75g,總量不超過75g),2小時血糖≧200mg/dl(11.1mmol/L)可診斷為糖尿病。血糖>140mg/dl~<200mg/dl為糖耐量減退(TGT)。
⑶如無糖尿病症狀,除上述兩項診斷標準外,尚須另加一指標以助診斷,即在OGTT曲線上1°或2°血糖≧200mg/dl或另一次空腹血糖≧140mg/dl。
⑷妊娠期糖尿病亦可採用此診斷標準。
以上診斷標準可歸納為表1。
表1 世界衛生組織(WHO)糖尿病診斷暫行標準
| 口服葡萄糖耐量試驗(OGTT) | 血糖mg/dl(mmol/L) | ||
| 靜脈全血 | 靜脈血漿 | 毛細血管全血 | |
| 糖尿病(DM) | |||
| 空腹和(或)糖負荷後2h | ≧120(6.7) ≧180(10.0) | ≧140(7.8) ≧200(11.1) | ≧120(6.7) ≧200(11.1) |
| 葡萄糖耐量異常(IGT) | |||
| 空腹和糖負荷後2h | <120(6.7) ≧120(6.7)~ <180(10.0) | <120(7。8) ≧140(7.8)~ <200(11.1)) | <120(6.7) ≧140(7.8)~ <200(11.1) |
診斷糖尿病時尚須除外影響糖耐量的多種因素,包括垂體前葉、腎上腺皮質、甲狀腺機能亢進等內分泌病,肥胖,肝病,多種藥物(如噻嗪類利尿劑、女性避孕藥、糖皮質激素、苯妥英鈉、氯苯甲噻二嗪等),應激狀態(如發熱、感染、急性心肌梗塞、手術治療等),失鉀等。
2.飯後2h血糖測定 進食相當於100g葡萄糖的糖類食物如饅頭2兩或米飯等後2h測定血糖,如超過140mg/dl者為耐量減低,≧200mg/dl者為糖尿病。
由於低糖飲食或飢餓狀態可使糖耐量減低,因此試前3d應注意調整飲食使糖類攝食不少於250g/d,方可獲得可靠結果。
對部分患者需估計其β細胞功能或血糖控制狀況時,尚可作下列測定:
1.空腹血漿胰島素測定 我院以放射免疫法測定空腹血漿胰島素正常範圍為5~20µu/ml,Ⅰ型患者往往在5µu/ml以下,有時低至測不出。Ⅱ型患者血漿胰島素濃度一般正常,少數也有偏低者,肥胖患者常高於正常,增高明顯者呈高胰島素血症,提示有胰島素抵抗。後者為代謝綜合徵中的一個組成,可認為是冠心病的危險因素之一,近年來備受關注。胰島素和胰島素原有免疫交叉性,因此均能為一般放免測定法測出,而對心血管的不良影響,胰島素原可能更甚於胰島素。已有研究胰島素原的測定應用於臨床。
2.胰島素釋放試驗 於進行口服葡萄糖耐量試驗時可同時測定血漿胰島素濃度以反映胰島β細胞貯備功能。Ⅰ型病者除空腹水平很低外,糖刺激後胰島素水平仍很低,呈低扁平曲線,尤其是計算同時的葡萄糖(G)與胰島素(IRI)比值,(IRI)/G,提示胰島素分泌偏低(正常值為25µu/mg)。Ⅱ型病者空腹水平可正常或偏高,刺激後呈延遲釋放。葡萄糖刺激後如胰島素水無明顯上升或低平,提示β細胞功能低下。
3.C肽測定 從胰島β細胞釋放的胰島素經肝腎後受胰島素酶等滅能,周圍血中每次循環將有80%被破壞,且其半壽期僅4.8分鐘,故血濃度僅能代表其分泌總量的極小部分。C肽與胰島素系從胰島素原分裂而成的等分子肽類物,不受肝臟酶的滅能,僅受腎臟作用而排泄,且其半壽期為10~11分鐘,故血中濃度可更好地反映胰島β細胞貯備功能。測定C肽時不受胰島素抗體所幹擾,與測定胰島素無交叉免疫反應,也不受外來胰島素注射的影響,故近年來已利用測定C肽血濃度或24小時尿中排泄量以反映β細胞分泌功能。
⑴血清C肽濃度測定:用放射2免疫法測定空腹時正常人血清C肽為1.0±0.23mg/dl,當口服葡萄糖後峰值見到60分鐘時,濃度為3.1ng/ml,據Block等測定,正常人口服100g葡萄糖後血清C肽從1.3±0.3ng/ml於60分鐘後上升至4.4±0.8ng/ml,Ⅱ型糖尿病者2小時後僅上升2.3ng/ml。另5例Ⅰ型病者曾治以胰島素5年以上者C肽水平很低,無論空腹時及刺激後均未能測出。
⑵24小時尿C肽測定:正常人24小時尿C肽為36±4µg,Ⅰ型病者僅1.1±0.5µg,Ⅱ型病者為24±7µg,每日C肽的排出量約相當於胰島素分泌量的5%,而胰島素排出量僅佔0.1%。
上述C肽測定對胰島素治程中的Ⅰ型病者可鑒定β細胞功能,目前不僅用於科研,臨床也常採用。
4.HbA1c測定 對空腹血糖正常而血糖波動較大者可反映近2~3月中血糖情況,正常值HbA1c6%,HbA1為8%,糖尿病者常高於正常。
5.果糖胺測定 血清果糖胺正常值2.13±0.24mmol/L(血漿中低0.3mmol/L),可反映近1~4周中血糖情況,與HbA1c相平行,糖尿病者不論Ⅰ型、Ⅱ型均增高,尤以Ⅰ型為高。
總之,糖尿病的診斷可根病史、臨床表現、輔以上述尿糖、血糖及OGTT而確定。此外,尚須查明有否各種併發症和伴隨症,并估計其病情輕重、類型、發展階段和各主要臟器功能狀態等,對本病的治療和預後非常重要。
近年來雖對遺傳問題、病毒感染、自身免疫和拮抗胰島素的激素等許多病因學上問題進行研究,但至今尚乏病因治療措施,環孢黴素A(cyclosporin A)僅對少數早期Ⅰ型病例有效,胰島移植及胰腺移植僅初見成效,人工胰臟(胰島素泵),雖能較好控制代謝,但對長期防治慢性併發症尚乏可靠數據。因此,臨床上對於患者的治療目的著重於嚴格控代謝紊,尤其是高血糖症,糾正肥胖和高血壓等并存症,促進β細胞功能恢復,保證正常生長發育與妊娠過程,防治併發症,提高生活質量。
自從93年美國多中心糖尿病控制和併發症臨床研究(DCCT)結果發表以來,嚴格控制高血糖可以明顯減少各種慢性併發症50~70%,已為各國糖尿病醫務人員所接受而不再懷疑。
具體防治措施如下:
(一)宣傳教育 由於約有半數以上的早期患者并無症狀或症狀輕微,常不能及時確診和得到防治,因而要大力開展糖尿病宣傳教育,讓已確診的患者瞭解糖尿病并逐漸熟悉飲食,運動,用藥和尿糖、血糖監測等基本措施的綜合治療原則,配合醫務人員提高控制質量;讓>50歲的對象,尤其是前述高危對象,每年做一次餐後2小時的血糖篩選檢查,使無症狀的患者盡多盡早得到確診和防治。
教育內容中尚需包括長期堅持飲食治療的重要意義,尿糖和血糖儀檢測方法,必須注意胰島素治療者,還應學會無菌注射法,低血糖反應及初步處理等。
教育活動可採用開學習班,座談會,觀看幻燈片,錄像帶,科技電影或甚而個別談心。
(二)飲食治療 適當節制飲食可減輕β細胞負擔,對於年長、體胖而無症狀或少症狀的輕型病例,尤其是血漿胰島素空腹時及餐後不低者,往往為治療本病的主要療法。對於重症或幼年型(Ⅰ型)、或脆性型病者,除藥物治療外,更宜嚴格控制飲食。飲食中必須含有足夠營養料及適當的糖、蛋白質和脂肪的分配比例。根據患者具體需要和生活習慣等估計如下:
1.按病人年齡、性別、身高從表2得出標準體重。
表2 男性理想體重(kg)
| 年齡 (歲) | 身高(cm) | ||||||||||
| 140 | 144 | 148 | 152 | 156 | 160 | 164 | 168 | 172 | 176 | 180 | |
| 15 | 41 | 42 | 43 | 44 | 45 | 47 | 48 | 50 | 53 | 55 | 58 |
| 17 | 44 | 44 | 45 | 47 | 48 | 49 | 51 | 53 | 55 | 58 | 61 |
| 19 | 45 | 46 | 47 | 49 | 50 | 51 | 53 | 55 | 57 | 60 | 67 |
| 21 | 47 | 48 | 49 | 50 | 51 | 53 | 54 | 56 | 59 | 61 | 64 |
| 23 | 48 | 49 | 50 | 51 | 52 | 54 | 55 | 57 | 59 | 62 | 65 |
| 25 | 48 | 49 | 50 | 51 | 52 | 54 | 56 | 58 | 60 | 62 | 66 |
| 27 | 48 | 49 | 50 | 51 | 53 | 54 | 56 | 58 | 60 | 63 | 66 |
| 29 | 49 | 50 | 51 | 52 | 53 | 55 | 56 | 58 | 60 | 63 | 66 |
| 31 | 49 | 50 | 51 | 52 | 54 | 55 | 57 | 59 | 61 | 64 | 67 |
| 33 | 50 | 51 | 52 | 53 | 54 | 56 | 57 | 59 | 62 | 64 | 67 |
| 35 | 50 | 51 | 52 | 53 | 55 | 56 | 58 | 60 | 62 | 65 | 68 |
| 37 | 51 | 52 | 53 | 54 | 55 | 57 | 58 | 60 | 62 | 65 | 68 |
| 39 | 51 | 52 | 53 | 54 | 55 | 57 | 59 | 60 | 63 | 65 | 69 |
| 41 | 51 | 52 | 53 | 54 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 43 | 51 | 52 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 45 | 52 | 53 | 54 | 55 | 56 | 58 | 59 | 61 | 63 | 66 | 69 |
| 47 | 52 | 53 | 54 | 55 | 56 | 58 | 60 | 62 | 64 | 66 | 70 |
| 49 | 52 | 53 | 54 | 55 | 57 | 58 | 60 | 62 | 64 | 67 | 70 |
| 51 | 52 | 53 | 54 | 56 | 57 | 58 | 60 | 62 | 64 | 67 | 70 |
| 53 | 52 | 53 | 54 | 56 | 57 | 58 | 60 | 62 | 64 | 67 | 70 |
| 55 | 52 | 53 | 54 | 55 | 57 | 58 | 60 | 62 | 64 | 67 | 70 |
| 57 | 52 | 53 | 54 | 55 | 56 | 58 | 59 | 61 | 64 | 66 | 69 |
| 59 | 52 | 53 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 61 | 51 | 52 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 63 | 51 | 52 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 65 | 51 | 52 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 67 | 51 | 52 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 69 | 51 | 52 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 71 | 51 | 52 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 73 | 51 | 52 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
| 75 | 51 | 52 | 53 | 55 | 56 | 57 | 59 | 61 | 63 | 66 | 69 |
表2續 女性理想體重(kg)
| 年齡 (歲) | 身高(cm) | ||||||||||
| 140 | 144 | 148 | 152 | 156 | 160 | 164 | 168 | 172 | 176 | 180 | |
| 15 | 38 | 29 | 40 | 42 | 44 | 45 | 48 | 51 | 54 | 58 | 64 |
| 17 | 42 | 43 | 44 | 46 | 47 | 49 | 52 | 54 | 58 | 62 | 67 |
| 19 | 43 | 44 | 46 | 47 | 49 | 51 | 53 | 56 | 59 | 63 | 69 |
| 21 | 43 | 45 | 46 | 47 | 49 | 51 | 53 | 56 | 59 | 64 | 69 |
| 23 | 44 | 45 | 46 | 47 | 49 | 51 | 53 | 56 | 59 | 64 | 69 |
| 25 | 44 | 45 | 46 | 48 | 49 | 51 | 54 | 56 | 60 | 64 | 69 |
| 27 | 45 | 46 | 47 | 48 | 50 | 52 | 54 | 57 | 60 | 65 | 70 |
| 29 | 45 | 46 | 47 | 49 | 51 | 53 | 55 | 58 | 61 | 65 | 71 |
| 31 | 46 | 47 | 48 | 49 | 51 | 53 | 55 | 58 | 61 | 66 | 71 |
| 33 | 46 | 47 | 48 | 50 | 51 | 53 | 56 | 58 | 62 | 66 | 72 |
| 35 | 46 | 48 | 49 | 50 | 52 | 54 | 56 | 59 | 62 | 67 | 72 |
| 37 | 47 | 48 | 49 | 51 | 53 | 55 | 57 | 60 | 63 | 67 | 73 |
| 39 | 48 | 49 | 50 | 52 | 53 | 55 | 58 | 60 | 64 | 68 | 73 |
| 41 | 48 | 50 | 41 | 52 | 54 | 56 | 58 | 61 | 64 | 69 | 74 |
| 43 | 49 | 50 | 41 | 53 | 55 | 56 | 59 | 62 | 65 | 69 | 75 |
| 45 | 49 | 50 | 52 | 53 | 55 | 57 | 59 | 62 | 65 | 69 | 75 |
| 47 | 50 | 51 | 52 | 53 | 55 | 57 | 59 | 62 | 65 | 70 | 75 |
| 49 | 50 | 51 | 52 | 53 | 55 | 57 | 59 | 62 | 66 | 70 | 75 |
| 51 | 50 | 51 | 52 | 54 | 55 | 57 | 60 | 62 | 66 | 70 | 75 |
| 53 | 50 | 51 | 53 | 54 | 56 | 58 | 60 | 63 | 66 | 70 | 76 |
| 55 | 51 | 52 | 53 | 54 | 56 | 58 | 60 | 63 | 66 | 71 | 76 |
| 57 | 51 | 52 | 53 | 55 | 56 | 58 | 60 | 63 | 67 | 71 | 76 |
| 59 | 51 | 52 | 53 | 55 | 56 | 58 | 60 | 63 | 67 | 71 | 76 |
| 61 | 50 | 51 | 53 | 54 | 56 | 58 | 60 | 63 | 66 | 70 | 76 |
| 63 | 50 | 51 | 52 | 54 | 55 | 57 | 60 | 62 | 66 | 70 | 75 |
| 65 | 50 | 51 | 52 | 54 | 55 | 57 | 60 | 62 | 65 | 70 | 75 |
| 67 | 50 | 51 | 52 | 54 | 55 | 57 | 60 | 62 | 65 | 70 | 75 |
| 69 | 50 | 51 | 52 | 54 | 55 | 57 | 60 | 62 | 65 | 70 | 75 |
| 71 | 50 | 51 | 52 | 54 | 55 | 57 | 60 | 62 | 65 | 70 | 75 |
| 73 | 50 | 51 | 52 | 54 | 55 | 57 | 60 | 62 | 65 | 70 | 75 |
| 75 | 50 | 51 | 52 | 54 | 55 | 57 | 60 | 62 | 65 | 70 | 75 |
或應用簡單公式算出標準體:
標準體重(kg)=身高(cm)-105
2.根據標準體重及工作性質,估計每日所需總熱量:休息者每日每公斤體重給予熱量0.1~0.13MJ(25~30kcal)、輕體力勞動者0.13~0.15MJ(30~35kcal)、中度體力勞動者0.15~0.17MJ(35~40kcal)、重度體力勞動者0.17MJ(40kcal)以上。兒童(0~4歲,每日每公斤體重0.2MJ(50kcal)、孕婦、乳母、營養不良者及消耗性疾病者應酌情增加,肥胖者酌減(可減至每日5MJ(1200kcal)以mw ),使病人體重下降到正常標準5%以下,常可使本病得到滿意控制。
3.食物中糖、蛋白質、脂肪分配比例(按熱量計)
⑴蛋白質按成人每日每公斤標準體重0.8~1.2g(平均1.0g)計算,約占總熱量的15~20%。孕婦、乳母、營養不良及有消耗性疾病者可酌加至1.5g左右,視需要而定。
⑵從總熱量減去蛋白質所供熱量為糖及脂肪的熱量,脂肪量可根據體徵、血脂高低及飲食習慣等需要而定,約每日每kg標準體重0.6~1.0g,占總熱量的30~35%以下。其餘為糖類,占總熱量的50~65%。按我國人民生活習慣,常用的主食量(碳水化合物)250~400g/d,糖尿病人可進食200~350g或更多,脂肪量約為40~60g。如肥胖病人,尤其有血脂蛋白