| 病名 | 急性胰腺炎(外科) |
| 別名 | Acute Pancreatitis, AP |
急性胰腺炎為腹部外科常見病,近年來重型胰腺炎發病率逐漸增多。由於它對生理擾亂大,而且對各重要臟器損害明顯,故死亡率甚高。有時可引起驟然死亡。重型胰腺炎死亡率為20%,有併發症者可高達50%。臨床病理常把急性胰腺炎分為水腫型和出血壞死型兩種。這種分類法固然可以說明其病理狀況,但胰腺炎的病情發展不是靜止的,隨著胰管的梗阻程度,以及胰腺間質血管(動、靜脈及淋巴管)的改變,其病理變化是在動態發展著。因此,以急性輕型胰腺炎和重型胰腺炎分類的方法,較適合於臨床的應用。重型胰腺炎(如出血壞死型)臨床醫生往往十分重視,但輕型胰腺炎(如水腫型)亦不能忽視,它可以發展為重型胰腺炎。
bubble_chart 病因學
本病病因迄今仍不十分明了,主要是因動物模型與臨床間差異較大。從現今的資料看,胰腺炎的病因與下列因素有關。
1.梗阻因素
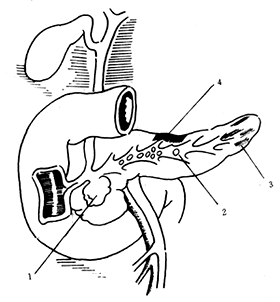
由於膽道蛔蟲、乏特氏壺腹部結石嵌頓、十二指腸乳頭縮窄等,而致膽汁返流(圖1)。但這種現象不能解釋:①30%左右的膽、胰管非共同通道的病例;②屍檢膽道無異常改變,而又無酗酒史者何以發生急性胰腺炎;③胰導管結紮後,一般發生慢性胰腺炎,而少有發生急性胰腺炎者。因此認為在一般情況下膽汁逆流入入胰管并不發生胰腺炎,必須造成胰管內一個高壓環境,如膽管下端明顯梗阻,膽道內壓力甚高,高壓的膽汁逆流胰管,造成胰腺腺泡破裂,胰酶進入胰腺間質而發生胰腺炎。動物實驗證明,低壓灌注胰管無急性胰腺炎發生,當壓力過高時則出現急性胰腺炎。臨床上可以見到,當做ERCP檢查時,若灌注壓力過高則發生急性胰腺炎。胰管經高壓灌注後,通過電子顯微鏡觀察,見破裂的部位在胰小管與胰泡的交接處,再沿著細胞的胞漿膜與基底膜之間滲透,最後破壞基底膜而滲至結締組織中。膽道有結石而未造成壺腹部梗阻又未引起膽液高壓逆流入胰管,則不應謂之膽源性急性胰腺炎。
⑴
⑵
圖1 胰腺炎梗阻因素
⑴⒈假性囊腫 ⒉胰結石 ⒊纖維化 ⒋組織變性
⑵⒈括約肌痙攣 ⒉纖維水腫 ⒊結石 ⒋腫瘤 ⒌原發性囊腫
 | 頂新製油 大絕韻 木崗雞蛋 每日C 味全 貝納頌 大醇豆 LCA506 36法郎 Jagabee加卡比薯條 康師傅 順胜實業 頂伸貿易 正義 統一眼鏡 應宏科技 台灣之星 德克士 崑山帆宏 福滿家(廣州市) 全家(中國) |
有時當結石通過Oddi括約肌時(特別是形狀不規則的),造成括約肌痙攣,則高壓的膽汁逆流入胰管而誘發胰腺炎。當膽道感染時細菌經過膽、胰共同的淋巴管回流入胰腺,再加之Oddi括約肌有不同程度的狹窄,而引起胰腺炎的發生。
胰腺內有細菌存在是否會發生胰腺炎?Widdison等進行動物實驗如下:他通過主胰管灌注胰酶而誘發實驗性胰腺炎。并將動物分成5組,第Ⅰ組接受示蹤大腸桿菌,第Ⅱ~Ⅴ組分別通過膽囊、主胰管、梗阻腎盂腔或結腸注入一定量大腸桿菌,24小時後作胰腺培養,僅結腸組在72小時後作培養,各組胰腺均有大腸桿菌生長。與經常有細菌滋生組比較,除結腸組外,胰腺炎嗇細菌生長率,胰腺細菌經常發現,但不一定發展成胰腺炎感染。
2.酒精因素
長期飲酒者容易發生胰腺炎,在西方是常見的現象,占70%。酒精性胰腺炎的發病機制:①酒精刺激胃的壁細胞產生大量胃酸,胃酸至十二指腸刺激腸壁的S細胞及小腸壁的Ⅰ細胞,而產生CCK-PZ,在短時間內胰管內形成一高壓環境;②由於洒精經常刺激十二指腸壁,則使腸壁充血水腫,并波及十二指腸乳頭,造成膽胰管開口相對的梗阻;③長期飲酒則胰管內蛋白質分泌增多,而形成胰管內的「蛋白栓」(Intraductal Protein Plug),造成胰腺管梗阻。在此基礎上當某次大量飲酒和暴食的情況下,促進胰酶的大量分泌,致使胰腺管內壓力驟然上升,引起胰腺泡破裂,胰酶進入腺泡之間的間質而促發急性胰腺炎。洒精與高蛋白高脂肪餐同時攝入,不僅胰酶分泌增加,同時又可引起高脂蛋白血症。這時胰脂肪酶分解甘油三酯釋出遊離脂肪酸而損害胰腺。
現將國內、外急性胰腺炎的病因分析列表於下(表一、表二)。
表一 國內急性胰腺炎之病因分析△
| 作者 | 時間 | 地區 | 病例數 | 酒精% | 膽道病% | 暴飲暴食% |
| 鄭顯里 | 1975 | 天津 | 820 | - | 16.83 | - |
| 申杰 | 1979 | 青島 | 81 | 2.5 | 35.8 | 30.9 |
| 黃志強 | 1980 | 重慶 | 618 | 9.2 | 20.8 | 3.4 |
| 錢允慶 | 1984 | 上海 | 71 | - | 20 | 20 |
△摘自錢禮,現代普通外科,1993.404
表二 國外急性胰腺炎的病因(Ranson 1983)
| 作者 | 時間 | 病人數 | 有關病因% | ||
| 膽石症 | 酒精性 | 其他 | |||
| Gliedman | 1970 | 2066 | 15 | 75 | 10 |
| Gillespie | 1973 | 93 | 34 | 23 | 43 |
| Olsen | 1974 | 100 | 12 | 87 | 16 |
| Howes | 1975 | 95 | 5 | 91 | 4 |
| Trapnell | 1975 | 590 | 54 | 4 | 42 |
| Jacobs | 1976 | 543 | 44 | 30 | 34 |
| Wellbourn | 1977 | 257 | 50 | 9 | 41 |
| Imrie | 1978 | 161 | 52 | 32 | 17 |
| Ranson | 1978 | 450 | 16 | 70 | 14 |
| Madsen | 1979 | 122 | 14 | 40 | 38 |
| Stiani | 1979 | 389 | 3 | 92 | 5 |
| Kelly | 1980 | 275 | 63 | 24 | 13 |
3.血管因素
胰腺的小動、靜脈急性栓塞、梗阻,發生胰腺急性血循環障礙而導致急性胰腺炎,這一現象已被證實。有人用直徑8~20μm的微粒體做胰腺動脈注射,則引起大的實驗性胰腺炎。Popper在胰腺炎的屍檢中,發現胰血管中有動脈粥樣化血栓。
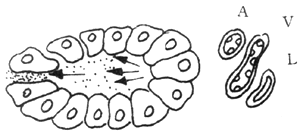
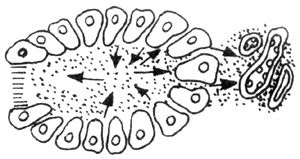
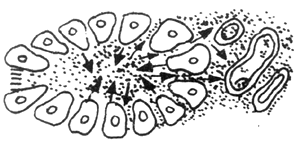
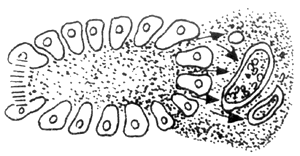
另一種血管因素是建立在胰管梗阻的基礎上,當胰管梗阻後,胰管內高壓,則將胰酶被動性的「滲入」間質,由於胰酶的刺激則引起間質中的淋巴管、靜脈、動脈栓塞,繼而胰腺發生缺血壞死,其發生的過程如圖2所示。從圖中可以看出,水腫型與出血壞死型胰腺炎,兩者無迥然的界限,前者若處理不當是可以發展成為後者。
1
2
3
4

5
圖2 血管因素
A:胰腺間質動脈 V:胰腺間質靜脈 L:胰腺間質淋巴管
1.正常胰腺腺泡,胰酶排入小胰管
2.胰管阻塞後,胰酶沿腺泡細胞逆流至胰腺間質,刺激動、靜脈、淋巴管
3~5.由於胰腺管阻塞程度加重,胰酶逆流入間質量增多,動、靜脈淋巴管最後完全栓塞
Reily對在心源性休克中胰腺缺血的基礎血流動力學的機制進行實驗,給豬造成心包堵塞誘發心源性休克,觀察胰腺的血流動力學,發現胰腺血流不均勻地減少比單獨休克動物的心排出量降低較明顯,胰腺缺血的增加是由於選擇性胰腺血管收縮和灌注壓降低所引起的。在心源性休克時發生的胰腺缺血,主要是由於選擇性胰腺血管收縮。
Castillo等研究300例體外循環手術病人,以觀察體外循環對胰腺有無損傷。在術後1、2、3、7和10天分別測定血澱粉酶、胰同工酶、脂酶。80例中23例有腹部發現,3例發生嚴重胰腺炎,11%術後死於繼發性胰腺炎。
4.外傷和醫源性因素
胰腺外傷使胰腺管破裂,胰腺液外溢以及外傷後血液供應不足,導致發生急性重型胰腺炎。醫源性胰腺炎有兩種情況會發生胰腺炎:一種是在做胃切除時發生,特別是在胃竇沖淡或十二指腸後壁潰瘍,穿透至胰腺,當行胃切除時,對胰腺上的潰瘍面進行搔刮而形成胰漏,胰液漏出對胰腺進行自我消化。另一種情況是手術并未波及胰腺,而發生手術後胰腺炎,這多因在胰腺鄰近器官手術招引的,可能是因Oddi括約肌水腫,使胰液引流不暢,損傷胰腺血運,各種原因刺激迷走神經,使胰液分泌過多等。
5.感染因素急性胰腺炎可以發生各種細菌感染和病毒感染,如腮腺炎病毒、腺病毒、甲型肝炎病毒以及細菌性肺炎等感染。病毒或細菌是通過血液或淋巴進入胰腺組織,而引起胰腺炎。一般情況下,這種感染均為單純水腫性胰腺炎,發生出血壞死性胰腺炎者較少。
6.代謝性疾病
(1)高鈣血症:高鈣血症所引起的胰腺炎,可能與下列因素有關:鈣鹽沉積形成胰管內鈣化,阻塞胰管使胰液進入間質而發生胰腺炎;促進胰液分泌;胰蛋白酶原轉變為胰蛋白酶。
(2)高脂血症:發生急性胰腺炎病例中約1/4的病人有高脂血症。可能是因為胰腺的小血管被凝聚的血清脂質顆粒栓塞,另外因高濃度的胰脂肪酶分解血清甘油三酯,釋出大量游離脂肪酸,造成胰腺小血管的損害并栓塞。當血中甘油三酯達到5~12mmol/L時,則可出現胰腺炎。
7.其他因素
如藥物過敏、藥物中毒、血色沉著症、腎上腺皮質激素、遺傳等。
急性胰腺炎(Acute Pancreatitis,AP)的發病機理主要是由於胰酶對胰腺的自我消化,對其周圍組織的消化,從而繼發一系列的器官的功能障礙。胰腺含有非常豐富的消化酶:蛋白酶、脂肪酶、澱粉酶等。胰腺腺泡分泌的酶主要有胰蛋白酶、糜蛋白酶、羧肽酶、彈力酶、磷脂酶A2、硬蛋白酶、脂肪酶、澱粉酶、核蛋白酶等。正常情況下除脂肪酶、澱粉酶、核蛋白酶是以活性型存在外,其他的均是以非活性狀態存在。在病理情況下,這些酶在胰腺導管及細胞內被活化後即可引起胰腺炎的發生。
胰酶在胰腺管內活化:
由於各種因素使膽汁、十二指腸液、腸酶、乳化脂肪、溶血卵磷脂等返流於胰管,則使胰管內的各種酶原活化,活化的酶對胰腺組織自我消化而發生胰腺炎。
胰酶在細胞內活化:
胰腺泡細胞內的酶原顆粒,因其中含有胰腺自身份泌的蛋白酶抑制因子(PSTI)防止細胞內酶活化。在細胞內形成的一種溶酶體酶,正常情況下此酶和酶顆粒是分離的。在致病因子作用下,則酶顆粒和溶酶體通過一種吞噬現象而融合,在pH低的情況下致使酶原在細胞內活化,而損害細胞自身。若胰酶流入組織間,將使胰腺病變進一步加重并引起鄰近的臟器損害,病變繼續發展則可發生多器官的損傷。
急性胰腺炎除上述的自身消化外,近年來對其又進一步進行了深入的研究,發現胰蛋白酶和抗胰蛋白酶系統、磷脂酶A和血栓素A2、胰腺血循障礙、氧自由基、細胞膜的穩定性以及內毒素等,在急性胰腺炎的發病機理中起了重要作用。
1.胰蛋白酶-抗胰蛋白酶系統
胰腺分泌多種抗胰蛋白酶因子,它能夠阻止胰蛋白酶的自身激活和自身消化。在重型胰腺炎時則局部的抗胰蛋白酶消耗,致使胰酶無限制的活化和自身消化。中胰蛋白酶(MT),它是不受抗胰蛋白酶抑制的,其含量在胰液中不及胰蛋白酶的10%,但活性比胰蛋白酶高3倍,對胰蛋白酶抑制因子有對抗作用,因此,它對胰腺的完整性以及胰外組織的損害是一嚴懲的威脅。
實驗證明抗胰蛋白酶治療急性胰腺炎療效是明顯的。干凍血漿內含有大量的抗胰蛋白酶,因而用干凍血漿於急性胰腺炎症人,不僅僅補充了膠體,同時亦補充了抗胰蛋白酶。
2.磷脂酶A和血栓素A2
磷脂酶A(PLA)被稱之為急性胰腺炎發病機理的「關鍵酶」。胰腺腺泡細胞的自身消化與PLA直接相關。急性胰腺炎起始時,PLA酶原被膽鹽、胰蛋白酶、鈣離子和腸肽等激活,繼而PLA水解腺泡細胞膜的卵磷脂,生成游離脂肪酶(FFA)以及溶血卵磷脂,後者可以使細胞膜崩潰,則細胞內各種消化酶釋出,而致胰腺出血壞死以及全身各器官損害。PLA在急性胰腺炎病人的血漿中存在有兩種不同的類型。
當PLA從膜磷脂分解FFA和溶血卵磷脂的過程中,產生一種血栓素A2,它使血管強烈收縮。當血栓素A2(TXA2)病理性增多,以及TXA2/PGI2的失調則可導致胰腺的供血發生障礙,同時又使細胞內溶酶體膜破壞以及細胞內鈣離子增加。當阻止TXA2的增加和維持TXA2/PGI2的平衡,則能有效的控制急性胰腺炎的發展。
3.溶酶體酶
以往認為急性胰腺炎時胰酶的激活是在腺泡的細胞外,近年發現酶原的激活可以通過溶酶體水解酶的作用在腺泡的細胞內發生。它的pH值較低,在酶性環境中能使胰蛋白酶抑制因子失活,而導致胰酶在細胞內激活。有人認為胰蛋白酶原在腺泡內被溶酶體激活是胰酶自身消化,和胰腺出血的重要一步。Wilson的研究認為溶酶體的參與是酒精性急性胰腺炎的重要原因。
4.胰腺血循環障礙
在胰腺炎時,胰腺的血流量反而減少,這一點與其他組織是迥然不同,而且胰腺組織對血流量的改變亦很敏感。在急性重型胰腺炎(急性出血性胰腺炎),胰腺血流量有明顯減少。在急性水腫型胰腺炎時,由於胰腺組織進行性缺血,若不予以解除,則因進行性缺血而致急性出血性胰腺炎。其原因是胰腺腺泡之間的血管栓塞以至梗阻,則胰腺缺血而發生壞死並且病變進行性加重。胰腺血循障礙另一因素是由於炎症刺激毛細血管,特別是微小的靜脈被栓塞進一步引起回流發生障礙,這是病變加重的又一原因。據研究,酒精性胰腺炎的發病,血循環障礙起著重要的作用。Ssafey等認為毛細血管的通透性增加是急性胰腺炎早期的重要病理生理現象。因而若能改善毛細血管的通透性,則對急性胰腺炎的治療尤為有益。毛細血管的通透性與氧自由基密切相關。Ven Ooijen的實驗指出,TXA2的增加是缺血所致的急性胰腺炎之關鍵因素,當缺血、缺氧則激活血小板,血小板的聚集加之TXA2的作用下,又加重了胰腺組織的缺血。
5.氧衍生自由基
近來的研究提示,氧自由基參與了急性胰腺炎的病理生理過程。氧自由基可以被體內的氧化物岐化酶(SOD)、過氧化氫酶(CAT)所清除。
氧化物岐化酶(SOD):存在於細胞液和線粒體中,是清除體內活性氧的特異性酶,可以加快活性氧岐化反應的速度,使正常代謝所產生的活性氧無害化。
過氧化氫酶(CAT):它可催化H2O2還原生成H2O,是細胞的一個重要的氧自由基的清除劑。
谷光甘肽過氧化物酶:它存在於胞漿和線粒體中,并參與多種過氧化物的還原反應。
在正常生理條件下,氧自由基與清除系統是平衡的。當氧自由基與清除系統的功能下降,導致活性氧對胰腺的損害。氧自由基可以使蛋白質、核酸、脂質和多糖等大分子損害,則胰腺的毛細血管通透性增加,導致胰腺水腫、出血和組織變性、壞死。在急性胰腺炎時,胰腺組織的SOD降低,血中的SOD活性增強,這是由於氧自由基引起的脂質過氧化物增加所致。氧自由基還可使膜的穩定性降低,則胰腺腺細胞溶酶體釋放以及各種胰酶的活化釋放;氧自由基又可激活磷脂酶A,從而使胰腺細胞膜上的卵磷脂分解,進一步造成胰腺組織的損傷。有人用SOD、CAT靜脈注射,見其活性時間很短,僅幾分鐘。故有人將這兩種酶與大分子聚合體乙烯乙二醇(PGE)結合,則在血漿中可以保持活性30~40小時,使大鼠的胰腺炎明顯減輕。
6.其他
內毒素血症亦參與了急性胰腺炎的發展過程。它是由急性胰腺炎時所產生的內毒素血症,反過來又加重了胰腺的損傷。有人為內毒素損害線粒體結構,影響ATP酶和氧化磷酸化偶聯過程,使能量代謝發生障礙;改變機體免疫功能;直接破壞單核吞噬細胞系統細胞內的溶酶體膜,從而造成細胞損害;並能使機體發生一系列的病理改變:血管舒縮功能、血小板及白細胞下降等。
總之,急性胰腺炎的發病機理是複雜的,由於各種酶的作用可使胰腺細胞的細胞膜、細胞器均可發生正、負作用。目前對其正處於深入研究階段。深信急性胰腺炎的發病,往往不是單一的機制,往往是多種因素相互促進,形成了一惡性循環鏈。怎樣能夠較好地切斷此鏈,則急性胰腺炎的治療將出現一個飛躍。
重型急性胰腺炎的臨床病理生理,概括於下(表1)。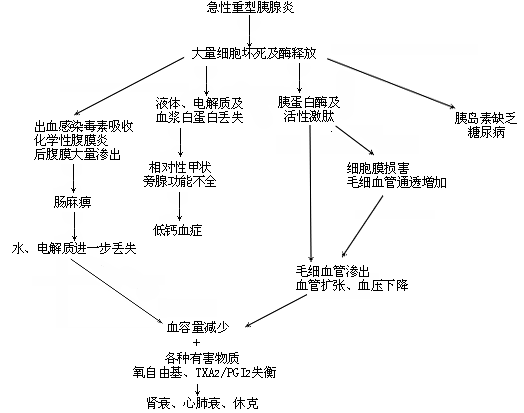
(一)胰腺分泌的物質
胰泌素,它是一種由25個氨基酸組成的多肽,其分泌細胞分佈在十二指腸和空腸上端,當小腸腔內pH減低時,則刺激胰泌素分泌增加。胰泌素增加HCO3-分泌,其增加量與劑量有關。大劑量的胰泌素可抑制胰酶的分泌。當慢性胰腺炎時,胰腺對胰泌素刺激的反應降低。
血管活性腸肽(VIP):是由小腸粘膜提取的具有強烈的擴血管作用的多肽,其分子結構與胰泌素近似,分泌VIP的細胞遍及整個腸道,以迴腸最高,它亦存在於腸壁的神經末梢,因而認為它亦屬於一種神經遞質。
CCK-PZ:是由十二指腸及空腸粘膜提取的一種肽類物質,它可刺激胰腺分泌大量胰液,稱之促胰酶素(pancreozymin)。它與縮膽囊素(choletystokinin)相同,同時有收縮膽囊和鬆弛括約肌的作用,故稱為縮膽囊素-促胰酶素(cholecystokinin-pancreozymin,CCK-PZ)。
抑制胰液分泌的物質
胰高血糖素,它可抑制胰泌素刺激時所引起的HCO3-的分泌。其抑制效應與劑量成正比。同時它對CCK刺激胰酶分泌呈競爭性抑制。
降鈣素(Calcitonin):可抑制胰泌素或者CCK刺激的胰腺分泌,其作用并不伴有降低血鈣,故不是由於低血鈣所致。
腎上腺素及去甲基腎上腺素:是刺激α-腎上腺素能受體的藥物,它通過引起強烈的血管收縮,減少正常胰腺或受刺激的胰腺的分泌。但如果血管收縮作用被α-腎上腺素能受體抑制劑所消除時,則去甲基腎上腺素反而增加胰腺的水與電解質分泌。
抗膽鹼能藥物:如阿托品等均能減少胰腺的分泌,其作用在對抗迷走神經興奮方面,勝於對抗CCK的直接刺激。
(二)急性胰腺炎時對全身各系統的影響
1.急性胰源性肺衰
急性胰腺炎,特別是急性重型胰腺炎對呼吸功能的影響,早在數十年前已被臨床醫生所注意。主要表現為氣急、發紺等表現,但這些症狀,并不完全與胰腺炎的嚴重性成正比。自70年代以來對其認識逐步加深,證實為成人呼吸窘迫綜合徵(ARDS)。
ARDS是重型急性胰腺炎的一個常見的嚴重的併發症。據統計,急性重型胰腺炎有進行性呼吸困難者占14.2~33%(首次發病者更為多見)。當出現呼吸困難的病人中,死亡率高達30~40%。1974年Feller分泌200例急性胰腺炎,其中83例系重症患者,18例有呼吸功能衰竭,17例(不吸氧)動脈血氧分壓低於9.33kPa者為38%。從發病後早期的肺功能檢查觀察,顯示肺的吸氣容量降低、阻力升高、肺的瀰散能力亦下降。從實驗性急性胰腺炎的觀察,表現有動靜脈分流量增加,每分鐘呼吸容量、氧耗量、肺的穩定性指數均有降低。急性呼吸功能不全可發生於急性胰腺炎的早期,動脈血低氧血症是早期常見的症狀,可發生於胸部X線片尚未出現改變之前。1974年Olsen報導一組病例(100例),80例做胸部X線檢查,25%有胸膜滲出、肺不張、肺炎等。
(1)急性胰腺炎所致的急性呼吸窘迫綜合徵(ARDS),原因甚多,尚無十分明確的論點,綜合當前一些學者的觀點如下:
A.關於胰酶的作用:糖類酶對組織似乎無害,而蛋白類和脂肪類酶則是致病的重要因素。胰蛋白酶包括胰蛋白酶原、糜蛋白酶原、羥基肽酶原、氨基肽酶、彈力蛋白酶原、膠原蛋白酶等。其中胰蛋酶原和彈力蛋白酶原的作用最為重要。活化的胰蛋白酶(Trypsin)幾乎可以激活所有的胰酶,也可激活因子Ⅶ,繼而激活凝血、纖溶、補體、激肽等多個酶系統。胰蛋白酶(Try)是一種肽鏈內切酶,人體Try可分為Try-Ⅰ和Try-Ⅱ兩種。Try-Ⅰ是一種陽離子蛋白質,Try-Ⅱ是一種陰離子蛋白質。正常人血中Try約300~460ng/dl,當急性胰腺炎時可高於10倍以上。彈力蛋白酶在肺出血和肺水腫中起主要作用,同時也引起血管壁破壞,同時它還可水解彈力纖維,并作用於其他多種蛋白質底物,如血紅蛋白、酪蛋白、纖維蛋白、白蛋白等。
脂肪酶類包括脂肪酶、共脂酶、膽固醇脂酶、磷脂酶A原。前三者主要是通過水解相應的底物,產生游離脂肪酸(FFA),FFA既可引起組織損傷,又是細胞毒性產物,可使細胞變性、壞死、溶解,對肺有明顯的損傷。磷脂酶A(PLA)分解卵磷脂也能產生FFA和溶血卵磷脂。PLA可被Try激活,PLA可分為PLA1和PLA2兩種,後者穩定,一般所產的PLA是指PLA2。
PLA的作用:水解卵磷脂,產生FFA和溶血卵磷脂;水解肺表面活性物質,引起肺不張;水解細胞膜上的磷脂,影響細胞膜通透性;水解線粒體膜上含磷脂的酶,從而影響細胞的氧化磷酸化過程;降低肺細胞溶酶體的穩定性,使其釋放,從而破壞組織,使肺灌注異常。
活化的Try能激活血中多個酶系統,改變血的粘滯度,肺灌注不足,則肺機能降低,表面活性物質合成減少,代謝產物在局部堆積,肺血管受損則通透性嗇。在急性胰腺炎時,多數情況下是心輸出量嗇,外周血管阻力降低,呈高動力循環狀態,這可能與肺動-靜脈分流明顯增加有關。一部分肺組織灌注不足,另一部分肺組織灌注過度現象,它可能是胰源性肺損傷的另一特點。
B.凝血系統的作用:急性胰腺炎時釋放Try入血,激活凝血系統,引起肺血栓形成和栓塞,在栓塞的基礎上釋放組織胺、5-羥色胺等血管活性物質,引起肺血管收縮,血管內膜損傷、通透性增加,肺水腫形成。
C.補體系統的作用:補體是血中一組免疫球蛋白分子。它一旦被激活,即形成鏈鎖反應而產生許多具有活性的碎片和複合物分子,導致多方面的損傷效應。如C3a、C5a、C567可使血管旁肥大細胞釋放組織胺,使血管機能紊亂和內膜損傷。補體(C3)被Try激活,C3亦可通過激活因子Ⅶ間接被激活。補體的損傷既是全身性的,肺部損傷當然亦不例外。
此外,激肽類物質通過Try的激活後,亦可使肺受損,血管擴張。損傷血管內膜,增加血管通透性等。
近年來自由基在胰腺炎時所致的肺損害,亦引起許多人的重視。如O2-、H2O2、OH-,它們均為過氧化,分解磷脂後釋放的物質,引起血管機能紊亂、內膜紊亂、通透性增加,還可使支氣管平滑肌收縮、粘膜水腫等。
另一些病例由於急性胰腺炎時,嚴重的脫水則血液為高凝狀態,同時血管內膜常有內膜炎,則集聚的血小板、白細胞、紅細胞將微血管栓塞。也有的病例由於急劇腹痛,通過神經反射,加之兒茶酚胺、組織胺等物質的作用,使肺的小動脈痙攣。組織胺除使小動脈收縮外,亦可引起小靜脈收縮,此外還有其他因素如急性胰腺炎時腹脹、膈肌抬高、胸膜滲出等,均可影響呼吸。少數病例因急性胰腺炎時纖維蛋白增多,積聚於肺內嚴重影響了氣體的交換。
(2)當肺衰發生時,發現肺的重量增加,突變,並有散在的多發性出血點。鏡檢可見肺間質充血、水腫、肺泡內外出血。有時可見局灶性肺泡塌陷融合。肺衰時功能殘氣量下降,死腔量與潮氣量之比增大,肺分流量增大,而肺的瀰散能力下降。過度換氣則發生呼吸性鹼中毒。由於乳酸血症逐漸加重,以及二氧化碳排出受阻,最後可成為呼吸性、代謝性酸中毒。
2.急性重型胰腺炎心血管的改變
重型胰腺炎可見驟然死亡病例,屍檢時發現心臟有明顯的損害,如心肌梗死、心內膜炎或傳導系統損害。
例:候×,58歲。3周來經常失眠,食慾不振。但無腹痛發燒等現象,尚能參加正常工作。某日晚因疲乏但能入睡,翌日凌晨5時發現病人已死亡。屍檢證實為出血壞死型胰腺炎,腹腔內有少量滲出液。澱粉酶>1064單位(溫氏單位),心包內有積液,左室前壁有大塊梗死病灶。
急性胰腺炎對心血管的損害,原因尚不甚明瞭。現今認為系胰酶進入血循環,引起冠狀動脈痙攣,胰蛋白酶及多肽類物質直接損害心肌;胰腺炎性滲出液積存於腹膜後,刺激腹腔神經叢,反射性廣泛性血管痙攣等因素。有人認為系胰腺內含有心肌抑制因子,其根據是將胰腺做成勻漿,注入動脈體內可抑制心肌用氧。亦有人提出在急性胰腺炎時,釋放某種物質,使心肌傳導系統興奮而致心率紊亂,以至心室纖維顫動。
3.急性胰腺炎時的腎衰
這種腎衰的發生屢見不鮮,除因低血容量外,正常的血容量者亦常見到,其原因是,胰酶產生的蛋白分解產物是腎臟的毒性物質,它作用於腎小球及腎小管,造成上皮細胞腫脹、脫落、壞死等改變;纖維蛋白及纖維蛋白原亦可沉積於腎小球上;內毒素又使腎小動脈阻力加大,而使腎血流量降低。
4.精神神經系統的改變
這種改變表現為譫妄、恍惚、昏迷以至精神失常等現象。感染、中毒、高燒,以及長期嗜酒酒精中毒等是精神症狀的原因。近年來發現急性重型胰腺炎時,產生大量的磷酸脂酶A,它與神經系統有強烈的親合力并損害神經。另外分解腦細胞的卵磷脂酶所產生的溶血卵磷脂(Lysolecithin),它為蛇毒成分具有強烈的神經毒性。少數病人由於血循中的胰脂肪酶增多,而使顱內脂肪壞死、軟化或出血,成為胰源性腦病。
5.電解質的改變
重型胰腺炎時脂肪酶將中性脂肪分解為甘油及脂肪酸,後者與鈣結合而皂化,引起急性低鈣已為我們所熟知。此外當急性重型胰腺炎時釋放胰高糖素,它促使甲狀腺釋放降鈣素而抑制甲狀旁腺自骨骼中動員鈣,但正常人注射胰高糖素,并未引起低血鈣,因此現今有人認為低鈣的原因,係甲狀旁腺素被蛋白酶分解,而不能維持鈣的水平。以上兩種情況經注甲狀旁腺素均可奏效。
急性胰腺炎的病理變化的不同階段,其全身反應亦不一樣,即使是同樣為出血壞死性胰腺炎,由於發病時間、機體的狀況亦可表現有較大的差異。概括的表現是:急性水腫型胰腺炎主要症狀為腹痛、噁心、嘔吐、發熱。而出血壞死型胰腺炎的症狀除上述情況外,又因胰腺有出血、壞死和自溶,故又可出現休克、高燒、黃疸、腹脹以至腸麻痺、腹膜刺激徵以及皮下出現淤血斑等。
腹痛,為最早出現的症狀,往往在暴飲暴食,或極度疲勞之後發生,多為突然發作,位於上腹正中或偏左。疼痛為持續性進行性加重似刀割樣。疼痛向背部、脅部放射。劇烈的腹痛多係胰腺水腫或炎性滲出壓迫、刺激腹腔神經叢。若為出血壞死性胰腺炎,發病後短暫時間內即為全腹痛,急劇腹脹,似向腹內打氣樣感,同時很快即出現輕重不等的休克。
噁心、嘔吐,為迷走神經被炎性刺激的表現,發作頻繁,起初為進入食物膽汁樣物,病情進行性加重(或為出血壞死性胰腺炎),很快即進入腸麻痺,則吐出物為糞樣。
黃疸,急性水腫型胰腺炎出現的較少,約占1/4。而在急性出血性胰腺炎則出現的較多。黃疸的出現多由於:同時存在膽管結石嵌頓;膽總管開口水腫、痙攣;腫大的胰頭壓迫膽總管下端;或因病情重篤,因腹腔嚴重感染而造成肝功能損害。
脫水,急性胰腺炎的脫水主要因腸麻痺,嘔吐所致,這是輕型的原因。而重型胰腺炎在短短的時間內即可出現嚴重的脫水及電解質紊亂,主要原因是因後腹膜炎症刺激,可有數千毫升液體滲入後腹膜間隙,似無形丟失。出血壞死型胰腺炎,發病後數小時至10幾小時即可呈現嚴重的脫水現象,無尿或少尿。
由於胰腺大量炎性滲出,以至胰腺的壞死和局限性膿腫等,可出現不同程度的體溫升高。若為輕型胰腺炎一般體溫在39℃以內,3~5天即可下降。而重型胰腺炎,則體溫常在39~40℃,常出現譫妄,持續數周不退,并出現毒血症的表現。
少數出血壞死性胰腺炎,胰液以至壞死的溶解的組織,沿組織間歇可達到皮下,并溶解皮下脂肪,而使毛細血管破裂出血,則局部皮膚呈青紫色,有的可融成大片狀。可在腰部(Grey-Turner徵)前下腹壁,亦可在臍周出現(Cullen徵)。
胰腺的位置深在,一般的輕型水腫型胰腺炎,在上腹部深處有壓痛。少數前腹壁有明顯壓痛。而急性重型胰腺炎,由於其大量的胰腺溶解、壞死、出血則前、後腹膜均被累及,全腹肌緊、壓痛,全腹脹氣,并可有大量炎性腹水,可出現移動性濁音。腸鳴音消失,出現麻痺性腸梗阻。
由於滲出液的炎性刺激,可出現胸腔反應性胸水。以左側為多見,可引起同側的肺不張,出現呼吸困難。
大量的壞死組織積聚於小網膜囊內,則在上腹可以看到一隆起性包塊,觸之有壓痛,往往包塊的邊界不清。少數病人腹部的壓痛等體徵已不明顯,但仍然有高燒、白細胞增高以至經常性出現似「部分性腸梗阻」的表現,這往往在腹腔或盆腔形成局限性膿腫,應做B超檢查和指肛檢查。
一.化驗室檢查
(1)澱粉酶的檢測:
這一古老的檢查方法雖已應用了半個多世紀,但對胰腺炎的診斷仍不失為良好而簡便可行的手段。由於胰酶在胰管內逆流入血或滲出液重吸收入血,則在急性胰腺炎時血、尿的澱粉酶有所升高。血澱粉酶正常值,溫氏單位<256單位,蘇氏單位<500單位。急性胰腺炎(輕型)發作後6~12小時即升高,48~72小時逐漸恢復正常,尿澱粉酶約在發病後12~24小時升高,要持續3~5天。但急性重型胰腺炎升高的時間要提前。臨床上對澱粉酶值的變化要作全面的分析,再結合臨床其他症狀才能做出正確的判斷。
澱粉酶值正常:病已痊癒可恢復正常,此時全身情況良好,已無腹部體徵。在急性出血壞死型胰腺炎,病情重篤,在初檢時或在治療中,澱粉酶不升高,則可說明病情進行性加重、進一步惡化。因胰腺腺泡大量的壞死、崩潰不已不能分泌澱粉酶──「枯竭」。這一現象在急性出血壞死型胰腺炎中時有發生,應引起高度重視。
澱粉酶升高:有時病人出現腹痛,并出現澱粉酶升高,但臨床的症狀、體徵并非胰腺炎。血清澱粉酶檢測往往是非特異性的,急性胰腺炎根據其病變程度可以有不同程度的升高。而臨床常見的一些急腹症澱粉酶亦可升高,如膽囊炎、膽石症、膽道梗阻、腸梗阻、潰瘍病穿孔、腸繫膜血栓形成以及使用嗎啡後。膽石症時澱粉酶升高,可能因排石時對Oddi括約肌的刺激,使之痙攣則一過性澱粉酶升高,潰瘍穿孔(特別是十二指腸球部穿孔)腸內容物含有大量的胰液,進入腹腔後澱粉酶被腹膜吸收則血澱粉酶值升高。腸梗阻後腸腔內腸液淤積澱粉酶通過受損的腸壁滲入腹腔而被吸收。因此,對澱粉酶的升高必須結合臨床進行判斷,決不可因澱粉酶升高而診斷為胰腺炎。
巨澱粉酶血症,是一罕見的病症,其原因不明,可能是由於病人血中的澱粉酶與大分子物質形成的複合物,不能通過腎小球濾過,將其貯存在血中。特點是血澱粉酶雖高,但尿澱粉酶正常或低。它可持續增高數月以至數年。
重型胰腺炎往往伴有腹腔大量炎性腹水,應做腹腔穿刺測定澱粉酶,穿刺抽出的腹水多為血性混濁的液體。澱粉酶含量可以很高。
Robent等利用測定急性胰腺炎病人血清和腹水中的胰脂酶和澱粉酶的水平來早期診斷壞死性胰腺炎。如果兩種酶在腹水中的水平高於血中的水平,則ES值(Enzymatic Score)記為「2」。任一種酶在腹水中在水平高於血中水平,ES值記為「1」。如果兩種酶在腹水中的水平低於血中水平,則ES值記為「O」。其觀察結果表明,ES值是一種很好的預測指標,它與死亡率、Ranson標準以及CT表現呈顯著相關。38例ES為「O」和「1」的病人,死亡率為5%,而35例ES為「2」的病人,死亡率為29%。
澱粉酶及其同工酶:如上所述血清澱粉酶的水平并不能預測胰腺炎的預後和嚴重程度,又由於它對胰腺炎的診斷有某些非特異性,因而其使用價值受到一定的影響。
澱粉酶同工酶的使用價值是:一方面可以鑒別非胰源性澱粉酶升高的疾病,如腮腺炎、腦血管疾病、呼吸系統疾病、腎功能衰竭、消化道潰瘍穿孔、膽系疾病、肝硬化以及大手術後等,可以出現澱粉酶升高,而P型(胰腺型)同工酶正常。另一方面用於後期併發症的篩選試驗。有的文獻提到,胰腺同工酶P3與假性胰腺囊腫關係密切,此時病人血中及囊腫液中的P3/P2比值升高。有人發現患者急性胰腺炎者,在出院時出現P3和持續性的胰蛋白酶升高,往往提示後期併發症的出現。并認為,P3是急性胰腺炎併發症的最敏感指標。
同工酶有兩種,一種來自胰腺(簡稱P),另一種來自唾液(S),它除來自唾液腺外,還來自汗腺、乳腺、支氣管、卵巢腫瘤以及前列腺等處。P型澱粉酶同工酶在切除胰腺後即完全消失。P型澱粉同工酶有P1、P2、P3。S型則有S1、S2、S3。正常人P型澱粉同工酶占40%,S型占60%。P型中P1占總數(P的)80~90%。P2占10~20%,P3占0~4%。正常人尿中的P型澱粉酶同工酶的活性高於S型。胰腺澱粉酶同工酶的分析,對於高澱粉酶血症的病因診斷提供了根據,據統計它可以糾正20~40%高澱粉血症的誤差。
澱粉酶-肌酐腎廓清率比值(ACCR):ACCR的正常比值為3.8~5.3%,若比值>5~6%則提示急性胰腺炎。Warshaw報導42例,比值升高者為93%,對照組44例無1例升高。因此,ACCR對急性胰腺炎的診斷具和重要價值。但其原因尚不清楚。有兩種可能性,一是胰澱粉酶的分子被蛋白溶解酶部分降解後容易通過腎小球丟失;另一種可能性是,急性胰炎時釋放到血循環中的激肽(Kinins)或其他血管活性物質,增加腎小球的通透性,并抑制澱粉酶在腎小管的重吸收。有人發現ACCR在急性胰腺炎以外的疾患亦可升高(如慢性腎衰、糖尿病酸中毒、燒傷、嚴重肝衰),因此只有在排除以上諸疾患時,才有特異性的意義。Warshaw認為ACCR之價值一方面是可以確診急性胰腺炎,另一方面亦可排除非胰腺炎的高澱粉酶血症。ACCR的計算方法是:
(尿澱粉酶/血清澱粉酶)×(血清肌酐/尿肌酐)×100
CRP與SPLA:Bouchler報導C反應蛋白(CRP)>100mg/L,檢出急性壞死性胰腺炎的陽性率為95%,他認為是急性壞死性胰腺炎檢測最準確的「血清因子」。Poulakaainen檢查53例急性胰腺炎入院第一天的平均CRP值,出血壞死性胰腺炎為280mg/L,輕症為45mg/L;血清磷脂酶A2(SPLA2)值,出血壞死型為40~60nmolLFFA/ml﹒min,輕型為<10nmolLFFA/ml﹒min,若為危重病人則更高;CRP>140mg/L,對重症胰腺炎的檢出敏感度為100%。SPLA2對重症胰腺炎檢出的敏感度和特異度,隨臨界值的選擇變動較大,當臨界值為11nmolLFFA/ml﹒min,特異度為100%,但敏感度為42%。若將CRP與SPLA2相結合檢查則對急性重症胰腺炎是一個良好的方法。CRP的檢測方便,快速,適於臨床應用,而SPLA2目前的檢測方法複雜費時,尚不能常規用於臨床,有待進一步簡化。
(2)核糖核酸酶:RNAase是來自因缺氧而崩潰的胰腺細胞。Warshaw和Iee的實驗觀察表明RNase正常者,僅有4%的病人有胰腺壞死和膿腫形成。而RNAase升高的13例,11例出現了胰腺壞死和膿腫形成,並在胰腺炎發作的頭幾天內升高。因此,認為RNAase可以做為胰腺壞死和晚期胰腺併發症的監測指標。經過檢測壞死性胰腺炎的血中此酶高於正常的10倍。近來又發現RNAase水平的升高對於急性壞兀性胰腺炎并不特異,其他諸如胰腺癌、白血病、大面積燒傷、創傷、腎衰時亦可升高。
(3)α1-抗胰蛋白酶與α2-巨球蛋白:α1-抗胰蛋白酶是一種急性期反應物,當急性胰腺炎時迅速上升,而α2-巨球蛋白水平則隨著嚴重度增加而下降。α1-抗胰蛋白酶檢出胰腺壞死的敏感度為77%,α2-巨球蛋白則為85%。
Begar於1985年對85例急性壞死性胰腺炎分析了數十項化驗和臨床參數後表明,有4項生化參數和增強CT檢查,以作為監測壞死性胰腺炎的依據,其正確率達80%以上(表一)。
表一 85例壞死性胰腺炎檢出率(Beger)
| 壞死性胰腺炎/間質水腫性胰腺炎 | 檢出率% |
| C反應蛋白>120mg/L(NL<40mg/L) | 93 |
| 增強對照CT示胰腺>50% | 88 |
| 乳酸脫氧酶>270IU/L(NL60~200IU/L) | 87 |
| α1抗胰蛋白酶>4.5g/L(NL1.5~3g/L) | 83 |
| α2巨球蛋白<1.3g/L(NL1.3~2.7g/L) | 82 |
表中提示:CRP和LDH的檢出率為最高,其升高不僅表示胰腺有急性炎症,并表示胰腺有壞死,對鑒別急性胰腺炎是否有壞死是很有價值的。
(4)載脂蛋白A2:載脂蛋白A2(APO-AII),在急性胰腺炎時顯著降低。Schender等檢測了20例急性胰腺炎病人血清中該物質的水平,除1例死亡者的APO-AII的濃度為21.6mg/dl外,其餘5例死亡者血中APO-AII均在20mg/dl以下。致死性胰腺炎用此法診斷確診率達80%。APO-AII下降的機理尚不清楚,尚需深入的探討。
(5)血清脂肪酶:此方法常用於急性胰腺炎的診斷。既往由於血清脂肪酶的檢測時間長(需24小時),難以滿足急診的需要,又因其達高峰的時間要在發病72~96小時,所以應用較少。現今方法有所改進,方法已簡化、快速。10余分鐘即可檢出;同時亦提高了敏感性與特異性。Heming Way用免疫法測定脂肪酶的活性,敏感度達100%,特異性達96%,無假陰性。另一優點是此酶在血液中持續的時間較長,可以預測。
(6)胰蛋白酶原激活肽:用免疫法特異性測定急性胰腺炎患者尿中的胰蛋白酶原激活肽(TAP),藉以早期預測急性胰腺炎的嚴重程度。Gudgeon通過TAP的檢測及臨床對照的結果,其最大敏感性和特異性分離值為2nmol/L。入院時預測敏感性為80%、特異性為90%、正確率達87%。TAP≧2nmol/L者75%伴1個以上嚴重併發症。TAP<2nmol/L者92%無併發症。
(7)其他:Berry發現血漿纖維蛋白原入院時水平,是急性胰腺炎預後的可靠因子。當>6.0g/L,提示為重症。
免疫反應性胰蛋白酶(IRT)及彈性蛋白酶-1,可以提高急性胰腺炎的敏感性以及特異性,但不能用其判斷嚴重度。
急性胰腺炎實驗診斷的方法甚多,均有其不足的一面。必須與臨床緊密結合,方能提高其診斷的價值。怎樣提高其陽性率和特異性,尚需進一步努力探索。
二.影像學檢查
急性胰腺炎的影像學檢查,為急性胰腺炎的確診及其預後的監測提供了更可靠的依據。
(1)超聲檢查:
急性水腫型胰腺炎:胰腺呈瀰漫性不同程度的腫大,胰腺實質回聲呈均勻低回聲(即弱回聲型),表現為稀疏的灰色光點。胰腺邊緣的輪廓一般均較規則,清晰,周圍血管多清晰可見。有的病人(約1/6)在超聲圖上可見有局限性炎症腫塊,胰管一般均正常,約8%的患者胰管可輕度擴張。急性胰腺炎約1/3的病人無任何超聲圖像上的異常。另2/3的病人在發病的最初12~24小時內,B超檢查可無任何異常發現。
急性出血壞死性胰腺炎(AHNP):胰腺內部出現瀰漫性散在分佈的低回聲,間以不規則分佈的中至高回聲;形狀不規則團塊狀高回聲;若有嚴重性出血時則在積血區可出現相應的無回聲區,在其深部則呈低回聲,并出現飄移徵象。當胰腺明顯腫脹時(特別是胰頭)可壓迫下腔靜脈及腸繫膜上靜脈,使血管前壁形使凹陷壓跡或被壓扁而呈平行線狀回聲;膽總管可有輕度至中度的擴張;主胰管因炎症、水腫、痙攣等而被不同程度的阻斷,內徑增寬;有腹腔積液時側臥位探測可見有液體無回聲區。約9%的病人可呈胰腺局限性炎性腫塊。但值得注意的是:有20~60%的病人由於脹氣而不能作超聲檢查,同時超聲對於區分液體積聚和實質壞死很難,而術中超聲檢查對於確定胰腺壞死情況、對於怎樣手術引流很有幫助。
(2)CT檢查及預後評估:
Nordestgaard對CT檢查早期胰腺炎,分為4級:A級,正常;B級,胰腺單純腫大;C級,炎症侵及一個胰周區域;D級,炎症侵及2個以上胰周區域。A、B級病人無死亡與併發症,31%的C級病人有嚴重併發症,44%的D級病人有危重的併發症。
出血壞死性胰腺炎的CT表現:胰腺呈現瀰漫性腫大,邊界模糊,當出現高密度影像(CT值>60Hu)時,則提示有出血的表現。
胰內或胰外積液:常見胰腺的腹側小網膜囊或左腎前間隙以及腎筋膜增厚。
胰床內巨大軟組織塊,內有壞死或液化,為蜂窩織炎表現,繼發感染可形成膿腫。
出血壞死性胰腺炎,胰外侵犯所累及部位為:小網膜腔;腸繫膜血管根部周圍;左結腸後區;右結腸後區;左腎區;右腎區;後腹膜等。因此,在CT片上要對這些區域的變化進行分析。CT對急性出血性胰腺炎的診斷和預後判斷的價值很高。對急性胰腺炎的確診率可達90%以上,臨床早期難以確定有無胰腺壞死,通過其檢查可獲早期確診。
CT增強造影檢查胰腺炎:通過增強前後胰腺密度的變化,對胰腺炎的病理變化更有意義。未用造影劑(未增強),胰腺密度從頭至尾呈減弱趨勢。平均密度由頭部43Hu減至尾部36Hu。注造影劑後,主動脈密度增加3倍,而胰腺僅增加2倍。無壞死的胰腺平均造影劑密度或在胰頭、體、尾切面造影劑密度無明顯差異。其胰尾密度>50Hu,而有胰腺壞死者,均無>50Hu者,且其平均胰腺、胰節段造影增強,胰腺與主動脈密度之比明顯減少。若血容量明顯不足時不宜行此項檢查。
ERCP和選擇性動脈造影:對於急性胰腺炎,特別是出血壞死性胰腺炎是不適合的,反而加重了胰腺的損害。
急性胰腺炎分為輕型及重型兩類。前者胰腺的損害輕微為單純性水腫,少有滲出,CT上幾無陽性發現,後者胰腺的損害十分嚴重,為廣泛的出血、壞死。急性水腫型胰腺炎發病率約占90%,死亡者較少。而出血壞死型胰腺炎死亡率甚高可達20~50%。多年來人們對急性出血壞死性胰腺炎進行了深入研究,特別是對其早期診斷以及全身生理的擾亂,提出了一些指標,擬求將死亡率降低到最低水平。
由於出血壞死性胰腺炎的病理變化、病理生理改變的輕重程度不一,當前幾乎找不到某一個單項指標:如臨床表現、化驗結果、影像檢查等,能夠作為確定診斷的依據,更不可能用某一指標能闡明其病理變化的嚴重性和預後的變化。自從1974年Ranson提出對出血壞死型胰腺炎用幾個指標來衡量其病變程度、手術指徵和/或預後的估計以來,相繼有許多學者提出對急性出血壞死性胰腺炎的判斷,以及對其預後的評估,各有其代表性。現將臨床常用的幾種標準簡介於下:
1.Ranson標準:Ranson於1974年提出預測急性胰腺炎嚴重性的指標11項(表一)。
表一 Ranson標準
| 入院時: |
| 1.年齡>55歲 |
| 2.白細胞數>16×109/L |
| 3.血糖>11.2mmol/L |
| 4.血清LDH>350IU/L |
| 5.血清GOT>250IU/L |
| 入院後48小時以內: |
| 1.紅細胞壓積下降>10% |
| 2.BUN升高>1.79mmol/L |
| 3.血清鈣<2mmol/L |
| 4.動脈血PO2<8kPa |
| 5.鹼缺乏>4mmol/L |
| 6.估計體液丟失>6000ml |
此標準已應用了20年,目前仍用於臨床。在這11項中,陽性指標越多越能肯定病變的嚴重性,而且預後越差。6年報一(1980年)Ranson總結了一些重型胰腺炎的病理與臨床後,提出:具備11項指標中的1~2項為輕型,可採取姑息療法治療,死亡率為0.9%;若上述11項指標中具備3項以上者為重型胰腺炎,應予以手術治療,死亡率很高,可達50~60%。Ranson於1978年報導一組病例其預後指徵與死亡率之間的關係(表二)。從表中可以看出,具備的指徵項目越多,則死亡率亦越高。0~2項指標死亡率為0.9%,3~4項指徵死亡率為16%,5~6項指徵死亡率為40%,7~8項指徵為100%。
表二 Ranson預後指徵和併發症死亡率之間的關係
| 病例 | 預後指徵項目數 | |||
| 02 | 34 | 56 | 78 | |
| 病例數 | 347 | 67 | 30 | 6 |
| 死亡或病重(%)(在ICU>7天) | 13(3.7) | 27(40) | 28(93) | 6(100) |
| 3(0.9) | 11(16) | 12(40) | 6(100) | |
2.Bank於1983年報導他對胰腺炎預後的臨床判斷指標。其特點是在Ranson的基礎上著重於胰外重要臟器的損害狀況。Bank的標準不僅是出血壞死胰腺炎的診斷依據,亦是手術的指徵(表三)。
表三 Bank臨床標準
| 心臟 | 休克、心動過速>130/分、心律不齊、心電圖異常 |
| 肺 | 氣急、羅音、PaO2<7.98kPa、ARDS |
| 腎 | 尿量<20ml/h、BUN上升和/或肌酐上升 |
| 代謝 | Ca++、pH、白蛋白減少或下降 |
| 血液學 | 紅細胞比積降低、DIC(血漿纖維蛋白裂解產物增多、血小板下降) |
| 神經學 | 煩躁、神志模糊、局限的體徵 |
| 出血性表現 | 體徵、腹腔穿刺 |
| 腹高度膨脹 | 嚴重麻痺性腸梗阻和腹水++ |
Bank的評價法:輕型為0,任何器官的症狀有1項或數項,則為重型胰腺炎。
3.Imrie(1976)提出胰腺炎預後判斷指標,共9項。與Ranson有些類似。對週身其他系統(或臟器)的損害并未涉及。其標準見下表(表四)。
表四 Imrie臨床標準
| 入院後48小時內: |
| 1.年齡>55歲 |
| 2.白細胞>15×109/L |
| 3.血糖>10.08mmol/L |
| 4.BUN>16.07mmol/L |
| 5.PaO2<2kPa |
| 6.血清鈣<2mmol/L |
| 7.血清白蛋白<30g/L |
| 8.LDH>60IU/L |
| 9.SGOAT或SGPT>200IU/L |
4.隨著影像學的手段(B超、CT等)廣泛的使用和它對胰腺損害檢出率很高這個角度來看,以上幾位的預後指標均不夠完善。因此,日本厚生省從自己的標準,結合Ranson的標準,參照了Bank的全身症狀的標準,又增加了B超和CT影像中所見,制定了一種對胰腺炎重度的判斷以及對其預後的預測的新標準,見下表(表五)。
表五 急性胰腺炎重度判斷標準及預後因素
| A.臨床症狀 | B.血液檢查 | C.影像情況 | |
| ⑴休克 | ⑴BE≦-3mmol/L | ⑵Ca≦1.88mmol/L | ⑵CT Ⅳ,Ⅴ級 Ⅳ:胰腺腫大、胰整體實質內部不均,炎症波及胰外,胰周有參出液貯留 Ⅴ:胰腺腫大、胰整體實質內部密度不均,炎性波及胰周或越過胰周 B超:可參考CT標準 |
| ⑴呼吸困難 | ⑴Ht≦30%(輸液後) | ⑵FBS≧11.2mmol/L | |
| ⑴神經症狀 | ⑴BUN≧14.3mmol/L或Cr≧176.8μmol/L | ⑵PaO2≦8kPa | |
| ⑴重症感染徵象 | ⑵LDH≧11.69μmol﹒S-/L | ||
| ⑴出血傾向 | ⑵TP≦60g/L | ||
| ⑵PT≧15秒 | |||
| ⑵血小板≦100×109/L | |||
重度:臨床徵象及血液檢查(1)中,即使1項為陽性即為重症;血液檢查及影像檢查(2)中,2項以上為重度。
重度判定時間:48小時以內(入院後),以後經常監測追蹤。
臨床徵象的診斷標準:
休克:是指收縮壓在10.7kPa以下,或雖在10.7kPa以上但有休克表現者。
呼吸困難:是指需要依賴於呼吸機者。
神經症狀:是指有中樞神經症狀,伴有意識障礙(只有疼痛反應)。
重症感染徵象:是指白細胞增多,體溫在38℃以上,血培養、內毒素測定為陽性,并證實腹內有膿腫。出血傾向:證實有消化道出血,和腹腔內出血。
中度:全身症狀較好,無明顯的循環衰竭和重要臟器功能不全。
無臨床徵象(1)、血液檢查(1)中的任何一項。血液檢查及影像檢查所見(2)中1項陽性者,為中度急性胰腺炎。
輕度:全身症狀良好。
無(1)及(2)中任何1項,血液檢查接近正常,為輕度急性胰腺炎。
5.亞特蘭大標準:1992年9月在亞特蘭大的國際性急性胰腺炎專題討論會上,制定了急性胰腺炎臨床分類標準如下:
急性胰腺炎:是胰腺的急性炎症過程,并涉及各種局部組織或遠處器官系統。起病急、上腹痛和不同程度的腹部體徵,嘔吐、發燒、心率快、白細胞增多,血、尿澱粉酶升高。胰腺大體觀:胰腺和胰周壞死和出血。鏡檢:胰間質水腫和脂肪壞死。
嚴重型急性胰腺炎:急性胰腺炎伴有器官衰竭和/或局部併發症,如壞死、膿腫或假性囊腫;Ranson標準≧3,APACHE1≧8;器官衰竭有休克(收縮壓<12kPa)、肺功能不全(PaO2≦8kPa)、腎功能衰竭(肌酐>177μmol/L)、胃腸道出血(>500ml/24h)、DIC(血小板≦10×109/L)、纖維蛋白原<1.0g/L、纖維蛋白分解產物≧80μg/ml、嚴重代謝紊亂(血鈣1.87mmol/L)。局部併發症有壞死、膿腫或假性囊腫。
輕度急性胰腺炎:伴有輕度器官功能不良,無上述嚴重急性胰腺炎的臨床表現,對恰當的補液反應良好。若48~72小時內未見好轉,則應考慮有併發症的可能。CT增強掃瞄顯示胰實質正常。病理變化以水腫為主,偶見胰實質及胰周圍脂肪壞死。
胰腺壞死:是瀰漫性或局灶性胰實質無生機,多伴有胰周圍脂肪壞死。臨床症狀嚴重。CT增強掃瞄見壞死區密度低於50Hounsfield單位,壞死區一般位於胰腺組織外周。臨床上應區分無菌性壞死和感染性壞死,并者不予手術治療,後者病情嚴重必須手術引流。兩者的區別可根據經皮穿刺抽吸培養的結果而定。
另將急性體液積聚、急性假性囊腫、胰腺膿腫亦列為急性胰腺炎的臨床分類系統之中。
6.我國的分類法:中華醫學會外科學會胰腺外科學組,於1992年5月在會議上(第四屆)提出重症急性胰腺炎臨床診斷及分級標準。
(1)臨床診斷標準:突發上腹劇痛、噁心、嘔吐、腹脹并伴有腹膜刺激徵,經檢查可除外胃腸穿孔、絞窄性腸梗阻等其他急腹症,并具備下列4項中之2項者即可診斷為重症急性胰腺炎。
①血、尿澱粉酶增高(128或256溫氏單位或>500蘇氏單位)或突然下降到正常值,但病情惡化。②血性腹水,其中澱粉酶增;高(>1500蘇氏單位)。③難復性休克(擴容後休克不好轉)。④B超或CT檢查顯示胰腺腫大,質不均,胰外有浸潤。
(2)分級標準:Ⅰ無重要器官功能衰竭的表現。Ⅱ有1個或1個以上的重要器官功能的衰竭。
[附]器官功能衰竭的依據
肺:呼吸困難,>35次/分,PaO2<8.0kPa。
腎:尿量<500ml/24h(20ml/h),BUN≧3.57mmol/L,Cr≧177μmol/L.
肝:黃疸,膽紅質>34μmol/L,SGPT達正常的2倍。
胃腸:腸麻痺、嘔血或黑便,估計出血量在1000ml以上,胃鏡見粘膜糜爛、潰瘍。
心:低血壓,心率≦54次/分或>130次/分,平均動脈壓≦6.5kPa。
腦:神志模糊、譫妄、昏迷。
凝血像:DIC、PT、PTT延長,血小板<80×109/L,纖維蛋白原<150~200mg/dl。
7.在國內不同地區均有其對急性胰腺炎的分類法,如浙江醫科大學錢禮的分類法;中國醫科大學附一院沈魁的分類法以及重慶醫科大學的分類法等,各有其特點,有簡有易。但因急性胰腺炎的病因、病理變化差異很大,即使是出血壞死性胰腺炎,它的差異亦可很大,隨著影像學的廣泛應用(如CT),必將會有一個國內更加完善的分類法。目前國內各地區的分類均是以臨床症狀、化驗檢查以及各重要臟器的影響等尚不能完全反映出急性胰腺炎的真正病理基礎。
急性胰腺炎的治療迄今仍是一個難題,首先是對治療方式的選擇:非手術治療抑或手術治療?非手術治療怎樣才能做到合理的補充血容量,減少併發症等,手術治療時機怎樣掌握,手術怎樣實施方為合理。關於急性胰腺炎的非手術治療和/或手術治療已探討了幾十年。隨著對急性胰腺炎變理變化的深入瞭解,迄今對其治療已有較為明確的意義:急性水腫型胰腺炎以姑息治療為主,而出血壞死型胰腺炎應根據情況予以治療。前者在急性胰腺中約占80~90%,後者約占10~20%。但急性水腫性胰腺炎與出血壞死性胰腺炎之間的界限是不能迥然分開的。急性水腫性胰腺炎可以轉化為急性出血壞死性胰腺炎,據統計約有10%左右可以轉化。因此,對急性水腫性胰腺炎在非手術治療的過程中,需嚴密觀察其病程的衍變。
急性水腫性胰腺炎與急性出血壞死性胰腺炎的治療觀點已比較一致。但對胰腺局限性壞死的治療觀點尚有所爭議。一種意見認為應手術引流,另一種意見認為可以採取姑息治療。從一些文獻報導和我們治療中的體會,我們認為對這一類型的胰腺炎亦應手術「清創」。理由是:一方面壞死是不可逆的,而壞死組織難以吸收,即使可以吸收病程亦很長,長期毒素吸收臨床症狀如持續腹痛、發燒等經久不退,另一方面在壞死組織中的毒性物質,如血管活性肽、彈力蛋白、磷脂酶A等將引起胰腺進行性自我消化,病變可能繼續擴大,則將導致全身中毒症狀進一步加重,以至出現多器官功能損害而致衰竭。非手術治療的一些方法,亦是出血壞死性胰腺炎的術前準備。
一.非手術療法
急性胰腺炎的非手術療法合理應用則大部分急性水腫型胰腺炎可以治療,同時也為出血壞死型胰腺炎做了較好的術前準備,非手術療法包括:防治休克,改善微循環、解痙、止痛,抑制胰酶分泌,抗感染,營養支持,預防併發症的發生,加強重症監護的一些措施等,見表10。
急性胰腺炎非手術治療主要措施如下:
一、抗休克
1.補充血容量改善微循環
2.解痙、止痛、維持電解質、酸鹼平衡
二、控制炎症發展
1.抑制胰液分泌
禁食、鼻胃管減壓
藥物:抗膽鹼能藥物、高血糖素等
抑制RNA,DNA合成:5-Fu、Sandotatin
低溫
胰腺照射△
2.胰酶的抑制:抑肽酶、阿托品、黃豆胰蛋白酶抑制劑
抗蛇毒抗毒素善得定(Sandostatin)
3.皮質類固醇
三、阻斷併發症
1.抗生素
2.胰島素
3.抗酸
4.肝素,纖維蛋白溶酶
5.低分子右旋糖酐
6.加壓素
四、支持及監護
1.ICU監護及肺、腎的保護
2.營養支持
△為試用階段,用於重型胰腺炎
(一)防治休克改善微循環
急性胰腺炎發作後數小時,由於胰腺周圍(小網膜腔內)、腹腔大量炎性滲出,體液的丟失量很大,特別是胰腺炎導致的後腹膜「化學性灼傷」喪失的液體量尤大。因此,一個較重的胰腺炎,胰周圍、腹腔以及腹膜後的滲出,每24小時體液丟失量,可達5~6L,又因腹膜炎所致的麻痺性腸梗阻、嘔吐、腸腔內積存的內容物等,則每日丟失量將遠遠超過5~6L。除體液丟失又造成大量電解質的丟失,并導致酸鹼失衡。在24小時內要相應的輸入5~6L液體,以及大量的電解質,若輸入速度過快則將造成肺水腫。為此對於大量輸液,又要減少輸液帶來的併發症,應通過CVP和尿量的監測,通過中心靜脈壓的高低,和尿量、比重的變化進行輸液。為改善微循環予以適量輸入右旋糖酐。右旋糖酐的分子量大、小,可靈活掌握,在快速擴大充血容量時用高分子,隨即改為低分子以改善微循環。并給以擴張微血管的藥物如654-2等。為擴充血容量并減少炎性滲出,輸入白蛋白。此外根據血生化所檢測的電解質變化,以及血氣所測得的酸鹼結果給補充鉀、鈣離子和糾正酸鹼失衡。
(二)抑制胰腺分泌
1.H2受體阻斷劑:如甲氰咪胍(cimetidine)、雷尼替丁(ranitidine)、法莫替丁(farmatidine)等均可減低胃酸的分泌,並能抑制胰酶的作用。有人將H2受體阻斷劑與5-Fu同時應用,認為對胰腺外分泌有更好的抑制作用,500~1000mg/日靜脈滴入。
2.抑肽酶(Trasylol):自Trapnell1974年大劑量應用於臨床以來,現已廣泛的臨床使用大劑量用以抑制胰液酶分泌。它除了能抑制胰蛋白酶分泌以外,並能抑制激肽酶、纖維蛋白溶酶的分泌。目前的劑量是2萬單位/公斤體重,加入靜脈輸液內滴注,1周為1療程。據Trapnell的報導,大劑量使用抑肽酶組死亡率明顯低於對照組。對水腫型急性胰腺炎的效果較好,但對出血壞死性胰腺炎的效果尚不能完全肯定。早在70年代、80年代我們亦熱衷於使用(但量較少),并未發現其有較明顯的效果,而且又可導致過敏反應之虞。
3.5-Fu(5-氟脲嘧啶):5-Fu可以抑制核糖核酸(DNA)和脫氧核糖核酸(RNA)的合成。在急性胰腺炎時,用其阻斷胰腺外分泌細胞合成和分泌胰酶。5-Fu治療急性胰腺炎始於70年代,現已逐漸用於臨床。1979年Mamm用腸激酶作胰腺管內注射,則誘發急性胰腺炎和高胰澱粉酶血症。當5-Fu與腸激酶一同注入胰管則可阻止胰腺炎的發生。1978~1981年學者報告用5-Fu治療急性胰腺炎300余例,能阻斷其病程的發展,并使澱粉酶、胰蛋白酶下降,死亡率與痊癒時間均減少。
黃延庭等1989年報導,10例出血壞死性胰腺炎,其中5例應用5-Fu治療無1例死亡,血、尿澱粉酶平均2~10天內降至正常,而另5例未用5-Fu組系按常規治療,僅存活3例,死亡2例。均死於中毒性休克和多器官功能衰竭。用量是:500mg溶500ml液體中靜脈滴注,連續1周,少數可用10天。丹東市第一醫院(1989年)報告17例壞死性胰腺炎,經手術引流,并用5-Fu治療僅死亡1例。
5-Fu的作用要注意要點:①免疫功能低下、重型胰腺炎但澱粉酶不高者或做胰部分切除後不宜使用;②對水腫性胰腺炎而且澱粉酶很高者、部分「清創」者應配合使用5-Fu,則效果良好,病人恢復順利。
禁食和胃腸減壓:這一措施在急腹症患者作為常規使用。急性胰腺炎時使用鼻胃管減壓,不僅僅可以緩解因麻痺性腸梗阻所導致的腹脹、嘔吐,更重要的是可以減少胃液、胃酸對胰酶分泌的刺激作用,而限制了胰腺炎的發展。由於食糜刺激胃竇部和十二指腸而致胰酶分泌,通常要禁食時間較長。當澱粉酶至正常後,再禁食1~2周,否則由於進食過早,而致胰腺炎復發。
(三)解痙止痛
急性重型胰腺炎腹痛十分劇烈,重者可導致疼痛性休克,并可通過迷走神經的反射,而發生冠狀動脈痙攣。因此應定時給以止痛劑,傳統方法是靜脈內滴注0.1%的普魯卡因用以靜脈封閉。并可定時將杜冷丁與阿托品配合使用,既止痛又可解除Oddi括約肌痙攣。另有亞硝酸異戊酯、亞硝酸甘油等在劇痛時使用之,特別是在年齡大的病人用此,既可解除Oddi括約肌的痙攣,同時對冠狀動脈供血大有益處。
(四)營養支持
急性胰腺炎時合理的營養支持甚為重要,若使用恰當則可明顯的降低死亡率,若使用不當有時可能增加死亡率。急性重型腹膜炎時,機體的分解代謝高、炎性滲出、長期禁食、高燒等,病人處於負氮平衡及低血蛋白症,故需營養支持,而在給以營養支持時,又要使胰腺不分泌或少分泌。因此,必須掌握其內在的規律,以發揮營養支持的最大作用。
1.急性胰腺炎營養支持應考慮下列幾點:①輕度胰腺炎,又無併發症者,不需要營養支持;②中、重度急性胰腺炎,早期開始營養支持(在血動力學和心肺穩定性允許的情況下);③初期營養支持,應通過腸道外途徑,要有足夠量的熱量;④病人在手術時做空腸造口輸供腸飼;⑤當病人的症狀、體檢以及CT檢查所顯示的胰腺圖像,基本正常後,再行口服飲食,但含脂肪要少。
2.急性重型胰腺炎的營養支持可概括與三個階段:第一階段應以全胃腸外營養(TPN)為主,一般需2~3周;第二階段通過空腸造口,予以腸道要素飲食2~3周,胃腸造口注腸道要素飲食(EEN),仍有一定的胰酶刺激作用,因此,EEN不宜過早使用;第三階段逐步過度到口服飲食。口服飲食開始的時間至關重要,必須對病人的全面情況進行綜合後,再逐步開始進食。
3.急性胰腺炎發病的一重要機理是:激活的胰酶使腺體和胰組織自化消化,因此在治療中的重要手段之一是要使胰腺分泌「靜止」或「休息」。在使用營養支持時,一定要把握住何種營養成分從哪種途徑進入體內,可使胰腺不分泌或少分泌(指消化酶),現對下列幾個問題進行討論。
(1)腸道營養和胰腺分泌:胃胰和腸胰反射則可刺激胰腺外分泌。有人對狗胃、十二指腸或空腸輸注要素飲食(含葡萄糖、脂肪、氨基酸)與輸注水對照進行研究,胃內輸注要素飲食後,胰分泌量、蛋白、碳酸氫鹽分泌量增加。十二指腸內輸注要素飲食後,胰分泌量增加,而蛋白、碳酸氫鹽的分泌無明顯改變。空腸內輸注要素飲食後,則胰外分泌量、蛋白、碳酸氫鹽分泌增加。對照組空腸輸注不增加胰外分泌。Stabile將不同劑量的乳化脂肪(Intralipid)注入實驗狗十二指腸,發現超過基礎量的乳化脂肪,則與蛋白和碳酸氫鹽排出量的關係明顯。因此,在急性胰腺炎的恢復期,口服脂肪飲食的量要低。而在腸飼中將脂肪飲食直接輸入空腸,排隊胃胰、腸胰的反射,則胰腺外分泌減少。
(2)胃腸外營養與胰腺分泌:
葡萄糖:Klein報導靜脈輸注葡萄糖可抑制胰腺外分泌,可能與血清滲透性增高有關。
氨基酸:Fried將晶體1-氨基酸輸入犬瘻管模型,發現胰蛋白分泌量無改變。Stabile輸注混合氨基酸液,不增加胰腺分泌、蛋白或碳酸氫鹽的排出。說明靜脈輸注氨基酸并不刺激人的胰腺分泌。
脂肪酸:經研究證實十二指腸內注入脂肪酸有明顯的刺激胰腺分泌作用。而靜脈輸注脂肪酸,則不刺激胰腺外分泌。
上述說明經靜脈內靜注氨基酸和葡萄糖,或單用脂肪乳劑,均不刺激胰腺外分泌。
(3)營養支持對急性胰腺炎的作用:TPN已是用作治療急性胰腺炎的營養支持和治療手段,但其效果如何?Feller對200例急性胰腺炎進行回顧,認為高營養支持有直接治療的效果,可使死亡率由22%降至14%。Motton1982年報導68例急性壞死性胰腺炎,經TPN治療者死亡率為15.6%,而未經治療者死亡率為22.4%,前者住院日32天,後者往院日45天。TPN在減少胰腺外分泌,使負氮平衡轉為正氮平衡,以及預防併發症方面均起到積極作用。TPN應用時糖量不宜過多,以免引起血糖升高。
近幾年來生長抑素八肽(Sandostatin)用於臨床,尤其是用於治療急性壞死性胰腺炎、胰漏(瘻)取得了良好的效果。現已廣泛的用於胰腺疾病、上消化道出血、胃腸道瘻管、消化系內分泌腫瘤。
Sandostatin(善得定),是一種人工合成的八肽環化合物,保留了天然的生長抑素的藥理活性,並有長效的作用。它能抑制生長激素和胃腸胰內分泌激素的病理性分泌過多;善得定可以明顯改善胰腺微循環,抑制胰酶釋放,又可減少肺的含水量及肺血管外水量,從而達到治療胰腺炎和防止肺水腫之目的(但大劑量的Sandostatin可導致胰腺微循環血量下降);善得定對Oddi括約肌的作用,近來通過動物實驗發現,它可使其壓力下降,當注射善得定3分鐘後壓力即開始下降,在5、10、15分鐘後下降尤為明顯,持續時間可達4小時,從而減少膽汁返流於胰管內。
(五)抗生素的應用
抗生素對急性胰腺炎的應用,是綜合性治療中不可缺少的內容之一。急性出血壞死性胰腺炎時應用抗生素是無可非議的。急性水腫性胰腺炎,作為預防繼發感染,應合理的使用一定量的抗生素。Beger報導138例壞死性胰腺炎作胰腺切除的組織細菌培養,陽性率為40%,壞死越重,時間越長則陽性率越高。胰腺壞死併發化膿感染的細菌種類較多,最常見的為腸道G-桿菌,如大腸桿菌、克雷伯氏桿菌、糞鏈球菌、產鹼桿菌、肺炎桿菌、變形桿菌、綠膿桿菌、金黃色葡萄球菌等。胰腺炎合併感染時死亡率甚高。因此,在急性胰腺炎時怎樣正確的使用抗生素是一個重要的課題。
1.抗生素的血-胰液屏障:將胰液及血清經微生物法、酶免疫法以及接用高效液相色譜法測定抗生素的含量,發現抗生素在透入胰液受很多因素的影響,最主要的是在胰腺內存在著一種類似血-腦屏障的血-胰屏障。抗生素在透過血-胰屏障時,首先要透過毛細血管內皮細胞層和基底膜,然後透過胰腺腺泡及導管的細胞膜而進入胰液。由於細胞膜含有較多量的脂類,故極性小、脂溶性高的抗生素較極性大、水溶性高者更易透過,抗生素的血清蛋白結合率、作為載體的結合蛋白分子量大小、抗生素的pH值均可影響其進入胰液。因此,在急性胰腺炎時,炎症影響細胞膜通透性改變,亦影響抗生素向胰液的透入。既然胰液中含有抗生素、胰組織中也應含有抗生素,但胰液中的抗生素濃度能否代表胰組織中的濃度,經實驗證明,胰組織和胰液中抗生素的濃度,兩者是平行的。到目前經研究的30多種抗生素能夠進入胰腺且能達到有效濃度的僅1/3。在血-胰屏障作用下有的抗生素如青黴素G和一些頭孢類抗生素不能進入胰組織。四環素、慶大黴素、氨苄青黴素進入胰組織很少,不能形成有效的濃度。
2.急性胰腺炎對抗生素應用的原則:能透過血-胰屏障;能在胰腺組織內形成有效濃度;能有效的抑制已知的致病菌。近些年研究,胰腺感染的菌種出現的頻率依次為:大腸桿菌、肺炎克雷伯氏菌、腸球菌、金葡菌、綠膿桿菌、奇異假單孢菌、鏈球菌、產氣腸桿菌、脆弱類桿菌等。近年來真菌(念珠菌)感染有所增加。經研究發現超廣譜的抗菌素,亞胺配已能(泰寧)以及環丙氟哌酸能夠抑制以上的細菌(脆弱桿菌除外);頭孢他唑(復達欣)、頭孢噻肟、西梭黴素、利福平、複方新諾明能夠抑制上述9種中的5種菌,氯林可黴素能抑制3種菌,而甲硝唑只能抑制脆弱菌






